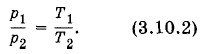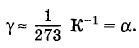|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 3. Температура. Газовые законы § 3.10. Закон Шарля. Газовый термометр
* Ж. Шарль в 1787 г., т. е. раньше, чем Гей-Люссак, установил и зависимость объема от температуры при постоянном давлении, но он своевременно не опубликовал своих работ. Закон ШарляСогласно уравнению (3.9.9)
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре. В этом и состоит закон Шарля. Из закона Шарля следует, что отношение давлений данной массы газа при постоянном объеме равно отношению его абсолютных температур:
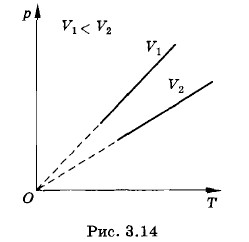
Процесс изменения давления газа, вызванный изменением температуры при постоянном объеме, называют изохорным (от греческих слов isos — равный и сhorа занимаемое место). Зависимость давления газа от температуры графически изображается прямой линией — изохорой. Разным объемам соответствуют различные изохоры (рис. 3.14). Так как с ростом объема газа при постоянной температуре давление его падает (закон Бойля—Мариотта), то изохора, соответствующая объему V2, лежит ниже изохоры, соответствующей объему V1 < V2. Все прямые заканчиваются в начале координат. Значит, давление идеального газа при абсолютном нуле равно нулю, так же как и объем. Предлагаем читателю самостоятельно убедиться в том, что закон Шарля можно записать в форме p=p0γТ, (3.10.3) где р0— давление газа при температуре Т = 273 К, а коэффициент γ, называемый температурным коэффициентом давления газа, равен температурному коэффициенту объемного расширения:
Коэффициент γ представляет собой относительное изменение давления при изменении температуры газа на 1 К. Газовый термометр постоянного объемаВ § 3.6 говорилось об идеальной газовой шкале температур. Для определения температуры по этой шкале используют газовые термометры. Наиболее простым газовым термометром является термометр постоянного объема. Измерение температуры с помощью этого термометра основано на законе Шарля (3.10.2).
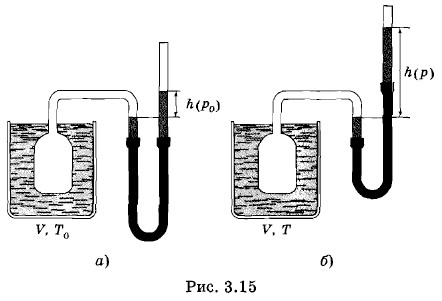
Газовый термометр представляет собой сосуд, заполненный тем или иным газом: азотом, аргоном или гелием. Сосуд соединен гибкой трубкой с ртутным манометром, которым измеряют давление газа и поддерживают его постоянный объем (рис. 3.15, а, б). Сначала измеряют давление при некоторой фиксированной температуре Т0 (см. рис. 3.15, а)*. Затем измеряют давление при температуре Т (см. рис. 3.15, б). Зная давление р0 при температуре Т0 и давление р при температуре Т, температуру Т определяют по формуле
* В качестве этой температуры обычно выбирается температура тройной точки воды, т. е. температура состояния, в котором лед, вода и водяной пар находятся в тепловом равновесии. Газовый термометр для точных измерений — очень сложное устройство. Для измерения температуры при физических исследованиях он применяется редко. Основное его назначение — использование для градуировки более простых, вторичных термометров. Эта градуировка производится в бюро стандартов, в метрологических институтах и в отдельных физических лабораториях. Для градуировки обычных, широко применяемых термометров используются вторичные термометры.
|
|
|