|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 4. Молекулярно-кинетическая теория идеального газа § 4.7. Измерение скоростей молекул газа
Средняя скорость теплового движения молекулИз сопоставления уравнения (4.4.9) с термодинамическим уравнением состояния идеального газа было получено выражение (4.5.5) для средней кинетической энергии поступательного движения молекул
Отсюда средний квадрат скорости поступательного движения равен
Квадратный корень из этой величины называется средней квадратичной скоростью:
Средняя квадратичная скорость мало отличается от наиболее вероятной скорости, определяемой выражением (4.6.9). Так как постоянная Больцмана равна отношению универсальной газовой постоянной к постоянной Авогадро
Вычисленные по этой формуле скорости
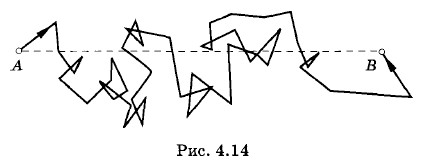
Как видно из таблицы, скорости молекул очень велики — порядка скорости артиллерийских снарядов — и несколько больше скорости звука в соответствующем газе. На первых порах такой результат вызвал замешательство среди физиков. Ведь если скорости молекул столь велики, то как объяснить, например, что запах духов, пролитых в комнате, распространяется довольно медленно; должно пройти несколько секунд, чтобы запах распространился по всей комнате. Однако объяснить этот факт оказалось довольно просто. Молекулы газа, несмотря на свои малые размеры, непрерывно сталкиваются друг с другом. Из-за большой скорости движения молекул число столкновений молекул воздуха в 1 с при нормальных атмосферных условиях достигает нескольких миллиардов. Средняя длина свободного пробега молекулы оказывается равной 10-4 — 10-5 см. Поэтому траектория каждой молекулы представляет собой очень запутанную ломаную линию (рис. 4.14). Большие скорости молекула имеет на прямолинейных отрезках ломаной. Перемещение же молекулы в каком-либо направлении в среднем невелико даже за время порядка нескольких секунд. При перемещении молекулы из точки А в точку В пройденный ею путь оказывается гораздо больше расстояния АВ.
|
|
|



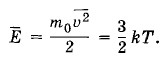

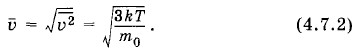
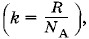 а массу молекулы можно выразить через ее молярную массу
а массу молекулы можно выразить через ее молярную массу 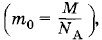 то из формулы (4.7.2) получается
то из формулы (4.7.2) получается

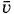 для различных газов при t = 0°С(Т = 273 К) приведены в таблице 1.
для различных газов при t = 0°С(Т = 273 К) приведены в таблице 1.