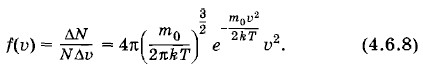|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 4. Молекулярно-кинетическая теория идеального газа Распределение МаксвеллаРаспределение модулей скоростей молекулНайдем среднее число молекул, скорости которых по модулю лежат в интервале от υ до υ + Δυ.
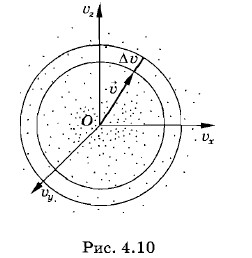
Распределение Максвелла (4.6.4) определяет число молекул, проекции скоростей которых лежат в интервалах значений от υx до υx + Δυx, от υy до υy + Δυy, от υz до υz + Δυz. Векторы этих скоростей оканчиваются внутри объема ΔυxΔυyΔυz (см. рис. 4.8). Таким образом задается среднее число молекул, имеющих определенный модуль и определенное направление скоростей, задаваемые положением объема ΔυxΔυyΔυz в пространстве скоростей. Все молекулы, модули скоростей которых лежат в интервале от и до υ + Δυ, располагаются в пространстве скоростей внутри шарового слоя радиусом υ и толщиной Δυ (рис. 4.10). Объем шарового слоя равен произведению площади поверхности слоя на его толщину: 4πυ2Δυ. Число молекул, находящихся внутри этого слоя и, следовательно, обладающих заданными значениями модуля скорости в интервале от υ до υ + Δυ, может быть найдено из формулы (4.6.2), если заменить объем ΔυxΔVυyΔυz на объем 4πυ2Δυ. Таким образом, искомое среднее число молекул равно
Так как вероятность определенного значения модуля скорости молекулы равна отношению
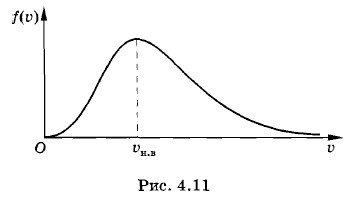
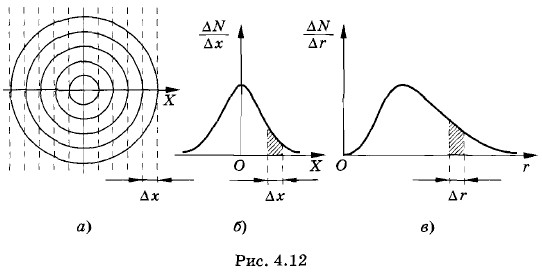
График, выражающий зависимость этой функции от скорости, показан на рисунке 4.11. Мы видим, что функция ƒ(υ) имеет максимум уже не в нуле, как плотность вероятности ƒ(υx, υy, υz). Причина этого состоит в следующем. Плотность точек, изображающих молекулы в пространстве скоростей, попрежнему будет наибольшей вблизи υ = 0, но за счет роста объемов шаровых слоев с увеличением модулей скоростей (~ υ2) происходит увеличение функции ƒ(υ). При этом число точек внутри шарового слоя растет быстрее, чем убывает функция ƒ(υx, υу, υz) вследствие уменьшения плотности точек. Можно пояснить сказанное наглядным примером. Допустим, обычную мишень с концентрическими кругами обстреливает достаточно меткий стрелок. Попадания пуль концентрируются вокруг центра мишени. Плотность попаданий — число попаданий на единицу площади — будет максимальной вблизи центра мишени. Разделим мишень на отдельные узкие полоски шириной Δx (рис. 4.12, а). Тогда отношение числа попаданий на данную полоску к ее ширине будет максимально вблизи центра мишени. Зависимость отношения числа попаданий в данную полоску к ее ширине имеет вид, показанный на рисунке 4.12, б. Здесь опять получается гауссова кривая, как и для распределения ƒ(υx) по проекциям скоростей (см. рис. 4.9).
Но совсем другой результат получится, если подсчитывать число попаданий в различные кольца мишени. В этом случае отношение числа попаданий в кольцо радиусом г к его ширине графически будет характеризоваться кривой, изображенной на рисунке 4.12, в. Хотя плотность попаданий по мере удаления от центра мишени убывает, но площади колец растут пропорционально r, что и приводит к смещению максимума кривой от нуля. Наиболее вероятная скорость молекулЗная формулу (4.6.8) для плотности вероятности модулей скоростей молекул, можно найти значение скорости, соответствующей максимуму плотности этой вероятности*. Скорость (ее называют наиболее вероятной) оказывается равной
* Это делается по правилам нахождения максимума известной функции. Нужно вычислить производную этой функции по скорости и приравнять ее нулю. Большинство молекул имеют скорости, близкие к наиболее вероятной (см. рис. 4.11).
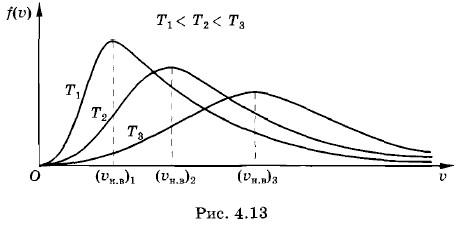
По мере увеличения абсолютной температуры Т наиболее вероятная скорость увеличивается и при этом кривая зависимости ƒ(υ) становится все более сглаженной (рис. 4.13). Роль быстрых молекулПри любой температуре имеется некоторое количество молекул, скорости которых, а значит, и кинетические энергии, заметно превышают средние. Известно, что многие химические реакции, например горение обычных видов топлива (дрова, уголь и т. д.), начинаются только при определенной, достаточно высокой температуре. Энергия, необходимая для начала процесса окисления топлива, т. е. горения (ее называют энергией активации), имеет порядок 10-19 Дж. А при температуре 293 К (комнатная температура) средняя кинетическая энергия теплового движения молекул составляет примерно 5 • 10-21 Дж. Поэтому горение не происходит. Однако увеличение температуры всего лишь в 2 раза (до 586 К) вызывает воспламенение. Средняя энергия молекул увеличивается при этом тоже в 2 раза, но число молекул, кинетическая энергия которых превышает 10-19 Дж, увеличивается в 108 раз. Это следует из распределения Максвелла. Поэтому при температуре 293 К вы чувствуете себя, читая книгу, комфортно, а при 586 К книга начинает гореть. Испарение жидкости также определяется быстрыми молекулами правого «хвоста» максвелловского распределения. Энергия связи молекул воды при комнатной температуре значительно больше кТ. Тем не менее испарение происходит за счет небольшого числа быстрых молекул, у которых кинетическая энергия превышает кТ.
|
|
|



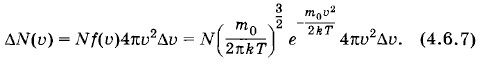
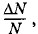 то для плотности вероятности получим
то для плотности вероятности получим