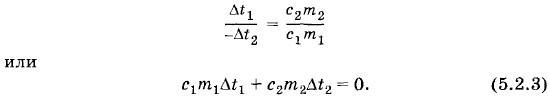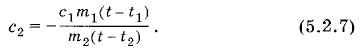|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 5. Законы термодинамики Количество теплотыКоличество теплоты. Уравнение теплового балансаОбозначим изменение температуры воды через Δt1 = t - t1, а изменение температуры железа через Δt2 = t - t2 (Δt2 < 0, если t2 > t1). Тогда уравнение (5.2.2) можно записать в форме
Равенство (5.2.3) имеет характер закона сохранения. Сумма двух величин, одна из которых относится к первому телу, а другая — ко второму, всегда равна нулю независимо от масс тел, их температур и выбора пар тел. Воду и железо мы ведь выбрали произвольно. Назовем Q1 = c1m1Δt1 количеством теплоты, полученным водой, a Q2 = с2m2Δt2 — количеством теплоты, отданным железом. Тогда можно утверждать, что количество теплоты в калориметрических опытах сохраняется: Q1 + Q2 = 0. (5.2.4) В равенстве (5.2.4) Q1 > 0, так как Δt1 > 0 (вода нагрелась от температуры t1 до температуры t > t1). Второе же слагаемое Q2 отрицательно (Q2 < 0), так как Δt2 < 0. Таким образом, полученное телом количество теплоты положительно, а отданное — отрицательно. Количество теплоты, отданное одним телом, равно по модулю количеству теплоты, полученному другим телом. Уравнение (5.2.4) называется уравнением теплового баланса. Итак, мы ввели новую величину — количество теплоты:
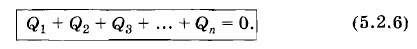
В общем случае теплообмен осуществляется между многими телами и уравнение теплового баланса запишется так:
Здесь Q1, Q2, Q3, ..., Qn — количества теплоты, полученные или отданные телами. ТеплоемкостьВыясним физический смысл величины с. Если масса тела равна единице и температура меняется на единицу, то согласно формуле (5.2.5) величина с численно равна количеству теплоты. Таким образом, постоянная с численно равна количеству теплоты, которое нужно сообщить единице массы вещества, чтобы изменить его температуру на 1 °С. Эту величину называют удельной теплоемкостью вещества. Она характеризует тепловые свойства вещества. Количество теплоты, необходимое для увеличения температуры на один градус у тела произвольной массы, называют теплоемкостью данного тела. Теплоемкость одного моля вещества называют молярной теплоемкостью. В опытах по наблюдению теплообмена между телами, как мы видели, количество теплоты сохраняется. Именно на основе этого факта возникла теория теплорода, в которой тепло рассматривалось как неуничтожимая, невесомая жидкость. С точки зрения теории теплорода теплоемкость аналогична обычной емкости сосуда. Подобно тому как при переливании в сосуд некоторого количества жидкости уровень ее в сосуде повышается тем больше, чем меньше его поперечное сечение (его емкость), так сообщение телу данного количества теплоты тем больше увеличит его температуру, чем меньше теплоемкость тела. Для измерения переданного количества теплоты была введена. специальная единица — калория. Под калорией понималось количество теплоты, которое нужно сообщить 1 г воды, чтобы увеличить его температуру на 1 °С. Таким образом, удельную теплоемкость воды по определению принимали равной 1 кал/(г • °С). Калориметрические опыты позволяют определить удельную теплоемкость любого вещества. Для этого нужно проследить за теплообменом исследуемого вещества с водой, удельная теплоемкость которой с принята за единицу. Из уравнения (5.2.3) следует:
Впоследствии (см. следующий параграф) прямыми опытами было доказано, что количество теплоты сохраняется только при определенных условиях. Открытие этого факта привело к гибели теорию теплорода. Но созданная во времена ее господства терминология, относящаяся к тепловым процессам, осталась.
|
|
|