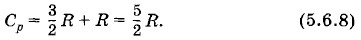|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 5. Законы термодинамики § 5.6. Теплоемкости газа при постоянном объеме и постоянном давлении
Если нагревать тело при постоянном давлении, то оно будет расширяться и совершать работу. Для нагревания тела на 1 К при постоянном давлении ему нужно передать большее количество теплоты, чем при таком же нагревании при постоянном объеме. Жидкие и твердые тела расширяются при нагревании незначительно, и их теплоемкости при постоянном объеме и постоянном давлении мало различаются. Но для газов это различие существенно. С помощью первого закона термодинамики можно найти связь между теплоемкостями газа при постоянном объеме и постоянном давлении. Теплоемкость газа при постоянном объемеНайдем молярную теплоемкость газа при постоянном объеме. Согласно определению теплоемкости
где ΔТ — изменение температуры. Если процесс происходит при постоянном объеме, то эту теплоемкость обозначим через Су. Тогда QV = CVΔT. (5.6.1) При постоянном объеме работа не совершается. Поэтому первый закон термодинамики запишется так: СуΔТ = ΔU. (5.6.2) Изменение энергии одного моля достаточно разреженного (идеального) одноатомного газа равно
Теплоемкость газа при постоянном давленииСогласно определению теплоемкости при постоянном давлении Ср Qp = СрΔТ. (5.6.4) Работа, которую совершит 1 моль идеального газа, расширяющегося при постоянном давлении, равна А' = RΔT*. (5.6.5) * Из формулы (5.6.5) видно, что универсальная газовая постоянная численно равна работе, которую совершает 1 моль идеального газа при постоянном давлении, если температура его увеличивается на 1 К. Это следует из выражения для работы газа при постоянном давлении А' = pΔV и уравнения состояния (для одного моля) идеального газа pV = RT. Внутренняя энергия идеального газа от объема не зависит. Поэтому и при постоянном давлении изменение внутренней энергии ΔU = CVΔT, как и при постоянном объеме. Применяя первый закон термодинамики, получим СрΔТ = CVΔT + RΔT. (5.6.6) Следовательно, молярные теплоемкости идеального газа связаны соотношением Cp = CV + R. (5.6.7) Впервые эта формула была получена Р. Майером и носит его имя. В случае идеального одноатомного газа
Теплоемкость идеального газа при изотермическом процессеМожно формально ввести понятие теплоемкости и при изотермическом процессе. Так как при этом процессе внутренняя энергия идеального газа не меняется, какое бы количество теплоты ему ни было передано, то теплоемкость бесконечна.
|
|
|



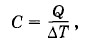
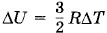 (см. § 4.8). Следовательно, молярная теплоемкость при постоянном объеме одноатомного газа равна
(см. § 4.8). Следовательно, молярная теплоемкость при постоянном объеме одноатомного газа равна