|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 6. Взаимные превращения жидкостей и газов § 6.3. Изотермы реального газа
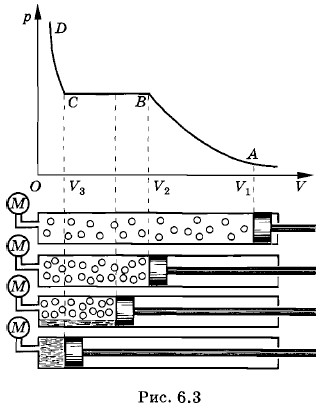
Пусть в цилиндре под поршнем (рис. 6.3) находится углекислый газ. Будем его медленно сжимать, при этом мы совершаем над газом работу, вследствие чего внутренняя энергия газа должна увеличиваться. Если мы хотим провести процесс при постоянной температуре Т, то нужно обеспечить хороший теплообмен между цилиндром и окружающей средой. Для этого можно поместить цилиндр в большой сосуд с жидкостью постоянной температуры (термостат) и сжимать газ настолько медленно, чтобы теплота успевала передаваться от газа к окружающим телам.
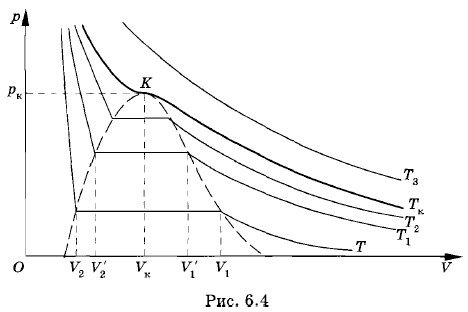
Проводя данный опыт, можно заметить, что вначале, когда объем достаточно велик (V > V2, см. рис. 6.3), давление углекислого газа с уменьшением объема растет в соответствии с законом Бойля—Мариотта, а затем при дальнейшем увеличении давления наблюдаются небольшие отклонения от этого закона. Данная зависимость между давлением и объемом газа изображена графически на рисунке 6.3 кривой АВ. При дальнейшем уменьшении объема, начиная со значения V2, давление в цилиндре под поршнем перестает меняться. Если заглянуть при этом в цилиндр через специальное смотровое окно, то можно увидеть, что часть объема цилиндра занимает прозрачная жидкость. Это значит, что газ (пар) превратился в насыщенный пар, а часть его превратилась в жидкость, т. е. сконденсировалась. Продолжая сжимать содержимое цилиндра, мы заметим, что количество жидкости в цилиндре увеличивается, а пространство, занятое насыщенным паром, уменьшается. Давление, которое показывает манометр, остается постоянным до тех пор, пока все пространство под поршнем не окажется заполненным жидкостью. Этот процесс изображен на рисунке 6.3 участком ВС графика. В дальнейшем при незначительном уменьшении объема, начиная со значения V3, давление очень резко нарастает (участок CD графика; см. рис. 6.3). Это объясняется тем, что жидкости малосжимаемы. Так как рассмотренный процесс происходил при постоянной температуре Т, график ABCD (см. рис. 6.3), изображающий зависимость давления газа р от объема V, называют изотермой реального газа. Участок АВ (V > V2) соответствует ненасыщенному пару, участок ВС (У3 < V < V2) — равновесному состоянию жидкости и ее насыщенного пара, а участок CD (V < V3) — жидкому состоянию вещества. Опыты показывают, что такой же вид имеют изотермы и других веществ, если их температура не слишком велика. Давление насыщенного параЧто будет происходить с насыщенным паром, если уменьшать занимаемый им объем, например, если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной? При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ. Это будет происходить до тех пор, пока вновь не установится динамическое равновесие, и плотность пара, а значит, и концентрация его молекул не примут прежнее значение. Следовательно, концентрация молекул насыщенного пара не зависит от его объема при постоянной температуре. Состояние насыщенного пара приближенно описывается уравнением р = nkT, полученным нами для идеального газа (см. § 4.5). Для насыщенного пара эта формула выполняется тем точнее, чем ниже температура и соответственно давление пара. Так как давление пропорционально концентрации молекул (р = nкТ), то из независимости концентрации молекул (или плотности) насыщенных паров от объема следует независимость давления насыщенного пара от занимаемого им объема. Независящее от объема давление пара, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара. При одной и той же температуре, как показывает опыт, давление насыщенного пара различных веществ различно. Например, при температуре 20 °С давление насыщенного пара эфира равно 440 мм рт. ст., насыщенного пара спирта — 45 мм рт. ст., а водяного насыщенного пара — 17 мм рт. ст. Семейство изотерм реального газаДо сих пор мы рассматривали только одну определенную изотерму реального газа. Познакомимся теперь с тем, как будет вести себя, например, тот же углекислый газ при другой, более высокой (но также постоянной) температуре Тг. Новая изотерма, как и прежняя, довольно точно совпадает с изотермой идеального газа при больших объемах. Начиная с некоторого объема V'1 < V1, она также идет горизонтально (рис. 6.4). Наконец, при объеме V2 > V2 изотерма круто поднимается вверх. Это означает, что при объеме V'2 весь цилиндр заполнен жидкостью.
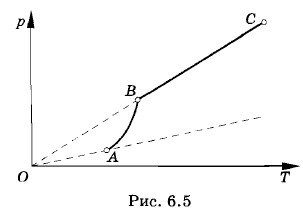
Если на основе опытных данных построить еще несколько изотерм, получится семейство изотерм реального газа (см. рис. 6.4). При этом обнаружится закономерность, общая для всех газов. Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа (пара). Объясняется это тем, что молекулы при более высокой температуре движутся быстрее, и необходима большая плотность газа для того, чтобы силы притяжения могли бы удержать молекулы около друг друга. Во-вторых, чем выше температура, тем больше объем, занимаемый жидкостью после того, как весь газ конденсируется. Ведь объем жидкости с увеличением температуры растет. Следовательно, длина прямолинейного горизонтального участка изотермы, соответствующего равновесию между жидкостью и насыщенным паром, с ростом температуры уменьшается. Конденсация начинается при больших плотностях газа и заканчивается при меньших плотностях жидкости. Другими словами, плотность газа и жидкости при одном и том же давлении тем ближе друг к другу, чем выше температура. Зависимость давления и плотности насыщенного пара от температурыЗнакомство с изотермами реального газа при различных температурах (см. рис. 6.4) позволяет сделать вывод о том, что давление насыщенного пара возрастает с увеличением температуры. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры. Однако зависимость р(Т), найденная экспериментально, не является пропорциональной, как у идеального газа при постоянном объеме (закон Шарля). С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (рис. 6.5, участок кривой АВ). Это становится особенно очевидным, если провести изохору через точку А (пунктирная прямая). Почему это происходит?
При нагревании жидкости с паром в закрытом сосуде часть жидкости превращается в пар. С ростом температуры увеличивается скорость испарения и равновесие между жидкостью и паром нарушается. Концентрация молекул, а следовательно, и плотность пара возрастают. Так продолжается до тех пор, пока плотность пара не увеличится настолько, что процесс конденсации уравновесит процесс испарения. В результате согласно формуле р = nkT давление насыщенного пара растет не только вследствие повышения температуры, но и вследствие увеличения концентрации молекул (плотности) пара. При этом главную роль в увеличении давления насыщенного пара играет рост концентрации молекул пара, а не повышение его температуры. Основное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема пара при постоянной температуре) меняется масса пара. Жидкость частично превращается в пар или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит. Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре в соответствии с законом Шарля (см. рис. 6.5, участок ВС).
|
|
|