|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 6. Взаимные превращения жидкостей и газов § 6.4. Критическая температура. Критическое состояние
Критическая температураПри достаточно высоких температурах горизонтальный участок изотермы реального газа (см. рис. 6.4) становится совсем коротким и при некоторой температуре обращается в точку (на рис. 6.4 — точка К). Эту температуру называют критической. Критической называется температура, при которой исчезают различия в физических свойствах между жидкостью и паром, находящимся с ней в динамическом равновесии. Каждое вещество имеет свою критическую температуру. Например, критическая температура для углекислоты СO2 равна tK = 31 °С, а для воды — tK = 374 °С. Критическое состояниеСостояние, соответствующее точке К, в которую обращается горизонтальный участок изотермы при температуре Т = ТK, называют критическим состоянием (критическая точка). Давление и объем в этом состоянии называют критическими. Критическое давление для углекислого газа равно 7,4 • 106 Па (73 атм), а для воды 2,2 • 107 Па (218 атм). В критическом состоянии жидкость имеет максимальный объем, а насыщенный пар — максимальное давление. Плотность жидкости и ее насыщенного пара при критической температуреМы уже отмечали, что при увеличении температуры возрастает плотность насыщенного пара (см. § 6.3). Плотность жидкости, находящейся в равновесии со своим паром, наоборот, уменьшается вследствие ее расширения при нагревании. В таблице 2 приведены значения плотности воды и ее насыщенного пара для разных температур. Если на одном рисунке начертить кривые зависимости плотности жидкости и ее насыщенного пара от температуры, то для жидкости кривая пойдет вниз, а для пара — вверх (рис. 6.6). При критической температуре обе кривые сливаются, т. е. плотность жидкости становится равной плотности пара. Различие между жидкостью и паром исчезает.
Газ и парМы много раз употребляли слова «газ» и «пар». Эти термины возникли в те времена, когда считалось, что пар может быть превращен в жидкость, а газ нет. После того как все газы были сконденсированы (см. § 6.7), для такой двойственной терминологии не осталось оснований. Пар и газ — это одно и то же, между ними принципиальной разницы нет. Когда говорят о паре какой-нибудь жидкости, то обычно имеют в виду, что его температура меньше критической и сжатием его можно превратить в жидкость. Только по привычке мы говорим о водяном паре, а не о водяном газе, о насыщенном паре, а не о насыщенном газе и т. д. Экспериментальное исследование критического состояния
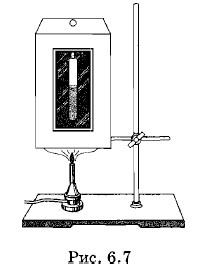
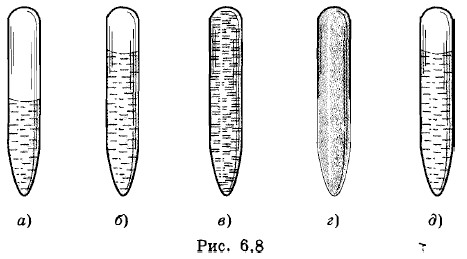
Эксперименты по изучению критического состояния выполнил в 1863 г. русский ученый М. П. Авенариус. Прибор, с помощью которого можно наблюдать критическое состояние (прибор Авенариуса), состоит из воздушной ванны (рис. 6.7) и находящейся внутри ванны запаянной стеклянной трубочки (ампулы) с жидким эфиром. Объем ампулы (ее вместимость) равен критическому объему эфира, налитого в трубочку. Пространство над эфиром в ампуле заполнено насыщенным паром эфира. При помощи газовой горелки или другого нагревателя воздушную ванну подогревают. За состоянием эфира наблюдают через стеклянное окошко в приборе. При комнатной температуре можно отчетливо видеть границу между жидкостью и паром (рис. 6.8, а). По мере приближения к критической температуре объем жидкого эфира увеличивается, а граница раздела жидкость — пар становится слабовыраженной, неустойчивой (рис. 6.8, б). При подходе к критическому состоянию граница между ними исчезает совсем (рис. 6.8, в).
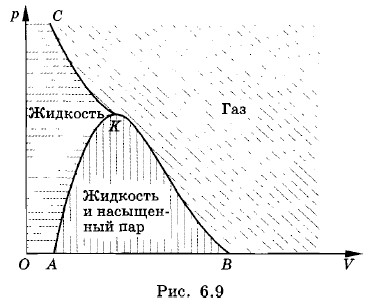
При охлаждении появляется плотный туман, заполняющий всю трубочку (рис. 6.8, г). Это образуются капельки жидкости. Далее они сливаются вместе, и опять возникает граница раздела между жидкостью и паром (рис. 6.8, д). Для опыта выбран эфир, так как он имеет сравнительно низкое критическое давление (около 36 атм). Критическая температура его тоже невелика: 194 °С. Если сжимать газ, поддерживая его температуру выше критической (см. рис. 6.4, изотерма Т3), причем, как и раньше, начать с очень больших объемов, то уменьшение объема приведет к возрастанию давления в соответствии с уравнением состояния идеального газа. Однако если при температуре ниже критической при определенном давлении происходила конденсация пара, то теперь образования жидкости в сосуде наблюдаться не будет. При температуре выше критической газ нельзя обратить в жидкость ни при каких давлениях. В этом и состоит основное значение понятия критической температуры. Диаграмма равновесных состояний газа и жидкостиЕще раз вернемся к рисунку 6.4, на котором изображены изотермы реального газа. Соединим все левые концы горизонтальных участков изотерм, т. е. те точки, которые соответствуют окончанию конденсации насыщенного пара и началу сжатия жидкости. Получится плавная кривая, оканчивающаяся в критической точке К. На рисунке 6.9 это кривая АК. Слева от кривой АК, между ней и критической изотермой (участок изотермы СК), расположена область, соответствующая жидкому состоянию вещества (на рис. 6.9 эта область выделена горизонтальной штриховкой). Каждой точке этой области соответствуют параметры р, V и Т, характеризующие жидкость в состоянии теплового равновесия. Соединим теперь плавной кривой все правые концы горизонтальных участков изотерм. Эта кривая на рисунке 6.9 тоже заканчивается в точке К. Две линии АК и ВК ограничивают область, каждая точка которой соответствует состоянию равновесия между жидкостью и насыщенным паром (на рис. 6.9 эта область выделена вертикальной штриховкой). За исключением области жидкого состояния и области равновесия жидкости с газом вся остальная область соответствует газообразному состоянию вещества. На рисунке 6.9 она выделена косой штриховкой.
В результате получилась диаграмма равновесных состояний газа и жидкости. Каждой точке на этой диаграмме соответствует определенное состояние системы: газ, жидкость или равновесие между жидкостью и газом.
|
|
|