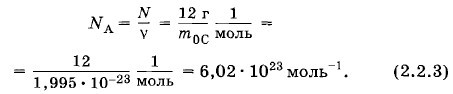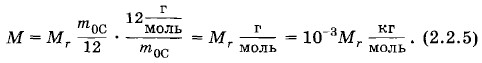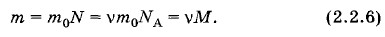|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 2. Основы молекулярно-кинетической теории § 2.2. Постоянная АвогадроЧисло молекул или атомов в моле вещества называют постоянной Авогадро. Это название дано в честь итальянского ученого XIX в. А. Авогадро**. ** А. Авогадро (1776—1856) — итальянский физик и химик; автор четырехтомного труда, который был первым руководством по молекулярной физике. Согласно определению моля постоянная Авогадро одинакова для всех веществ. Она равна, в частности, числу атомов в моле углерода, т. е. в 12 г углерода. Для вычисления постоянной Авогадро надо найти массу одного атома углерода (или любого другого атома). Грубую оценку массы можно сделать так, как это было выполнено для массы молекулы воды. Наиболее точные методы определения массы основаны на отклонении пучков ионов электромагнитным полем. Измерения дают для массы атома углерода m0С = 1,995 • 10-23 г. Отсюда постоянная Авогадро равна
Наименование моль-1 указывает, что NA — число атомов любого вещества, взятого в количестве одного моля. Если количество вещества ν = 2,5 моль, то число молекул в теле N = νNА = 1,5 • 1024. Существует много других методов определения постоянной Авогадро, не связанных с нахождением масс атомов. Все они приводят к одним и тем же результатам. Постоянная Авогадро играет важнейшую роль во всей молекулярной физике и является универсальной постоянной. Огромная величина постоянной Авогадро показывает, насколько малы микроскопические масштабы по сравнению с макроскопическими. Тело, обладающее количеством вещества 1 моль, имеет привычные для нас макроскопические размеры. Молярная массаНаряду с относительной молекулярной массой Мr, в физике и химии широко используется понятие молярной массы М. Молярной массой называют массу вещества, взятого в количестве одного моля. Согласно этому определению молярная масса равна произведению массы молекулы на постоянную Авогадро:
Молярная масса простым образом связана с относительной молекулярной массой. Подставив в формулу (2.2.4) выражения m0 из (2.2.2) и NA из (2.2.3), получим
Например, молярная масса воды Н20 равна 18 г/моль, или 0,18 кг/моль, так как относительная молекулярная масса воды приближенно равна 18. Масса m произвольного количества вещества ν и молярная масса М связаны соотношением
Так, масса 3 моль воды равна m = 3 моль • 0,018 кг/моль = 0,054 кг. Используя формулы (2.2.6) и (2.2.2), можно получить формулу для числа молекул в теле в зависимости от массы тела m и молярной массы М
|
|
|