|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
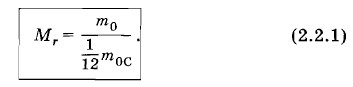
Глава 2. Основы молекулярно-кинетической теории § 2.2. Масса молекул. Постоянная АвогадроМассы молекул очень малы, если выражать их в граммах или килограммах, а число молекул в макроскопических телах огромно. С очень маленькими и очень большими числами иметь дело неудобно. Ученые нашли довольно простой способ избежать этого неудобства и характеризовать массы молекул и их число вполне обозримыми числами, не выходящими далеко за пределы сотни. Сейчас вы познакомитесь с тем, как это делается. Масса м олекулы водыВ предыдущем параграфе мы выяснили, что в 1 г воды содержится 3,7 • 1022 молекул. Следовательно, масса одной молекулы равна
Массы такого же порядка имеют и молекулы других веществ, исключая огромные молекулы органических соединений. Например, масса молекулы гемоглобина превышает массу молекулы воды в несколько десятков тысяч раз. Относительная молекулярная массаТак как массы молекул очень малы, удобно использовать не абсолютные значения масс, а относительные. По международному соглашению, принятому в 1961 г., массы всех
молекул сравнивают с * Точнее, с Относительной молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) данного вещества к
Относительные атомные массы всех химических элементов точно измерены. Складывая относительные атомные массы, можно вычислить относительную молекулярную массу. Например, относительная молекулярная масса воды Н20 приближенно равна 18, так как относительные атомные массы водорода и кислорода примерно равны 1 и 16 : 2 • 1 + 16 = 18. Количество веществаЧем больше атомов или молекул в макроскопическом теле, тем, очевидно, больше вещества содержится в нем. Число молекул в макроскопических телах огромно. Поэтому удобно указывать не абсолютное число атомов, а относительное. Принято сравнивать число молекул или атомов в данном теле с числом атомов, содержащихся в углероде массой 12 г. Относительное число атомов или молекул в теле характеризуется особой физической величиной, называемой количеством вещества. Количеством вещества ν называют отношение числа молекул N в данном теле к числу атомов NА в 12 г углерода*: * Если вещество состоит из отдельных атомов, не объединенных в молекулы, то здесь и в дальнейшем под числом молекул надо подразумевать число атомов.
Зная количество вещества ν и число NА, мы тем самым знаем число молекул N в веществе. Количество вещества выражают в молях. Моль — это количество вещества, содержащего столько же молекул, сколько атомов содержится в углероде массой 12 г. Если количество вещества равно, например, 2,5 моль, то это означает, что число молекул в теле в 2,5 раза превышает число атомов в 12 г углерода, т. е. равно 2,5NА.
|
|
|



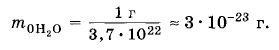
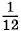 массы атома углерода* (так называемая углеродная шкала атомных масс). Главная причина выбора углеродной шкалы атомных масс состоит в том, что углерод входит в огромное число различных органических соединений. Этот выбор позволяет очень точно сравнивать массы атомов тяжелых элементов с массой атома углерода. Множитель
массы атома углерода* (так называемая углеродная шкала атомных масс). Главная причина выбора углеродной шкалы атомных масс состоит в том, что углерод входит в огромное число различных органических соединений. Этот выбор позволяет очень точно сравнивать массы атомов тяжелых элементов с массой атома углерода. Множитель