|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
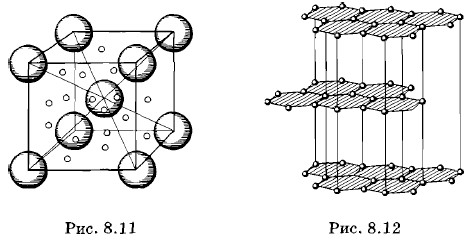
Глава 8. Твердые тела и их превращение в жидкости § 8.2. Кристаллическая решетка (окончание)Ионные кристаллыКоллективизация валентных электронов связывает также атомы ионных кристаллов. К их числу относятся неорганические соединения NaCl, AgBr и др. Но в ионных кристаллах, например в кристалле поваренной соли, коллективизация электронов в сущности сводится к экспроприации хлором одного электрона у натрия. Все валентные электроны движутся по узлам решетки, занятым хлором, и кристалл фактически состоит из ионов противоположных знаков. Связь в этом случае обеспечивается электростатическими силами притяжения. Металлические кристаллыПри образовании куска металла из отдельных атомов валентные электроны полностью утрачивают связь со своими атомами и становятся «собственностью» всего куска в целом. Положительные ионы окружены «электронным газом», образованным коллективизированными электронами. Этот газ заполняет все промежутки между ионами и стягивает их электрическими силами. В ковалентных кристаллах коллективизированные электроны циркулируют по строго определенным путям. В металле же электроны оказываются свободными и могут перемещаться по всему куску в любых направлениях. Это проявляется, например, в том, что металлы хорошо проводят электрический ток, в то время как ковалентные кристаллы в большинстве случаев являются изоляторами или полупроводниками. Очень слабая связь валентных электронов металла с атомами — вот причина той относительной свободы, которую имеют электроны внутри металлов. У ковалентных кристаллов эта связь значительно прочнее. На рисунке 8.11 изображена элементарная ячейка кристалла натрия. Она имеет объемно-центрированную кубическую структуру: положительные ионы натрия располагаются в вершинах куба и в его центре. Итак, только в молекулярных кристаллах связь осуществляется силами Ван-дер-Ваальса. В остальных твердых телах в той или иной форме происходит коллективизация электронов. Строение кристалла объясняет его свойстваМы говорили, что кристалл ограничен плоскими гранями и прямыми ребрами. Этот факт можно объяснить тем, что плоскости и ребра кристалла всегда проходят через узлы пространственной решетки. Можно понять, почему кристаллы одного и того же вещества могут существовать в нескольких модификациях (полиморфизм). Это объясняется разным строением пространственной решетки. На рисунках 8.10 и 8.12 изображены кристаллические решетки двух модификаций углерода: алмаза и графита. Представление о внутреннем строении кристалла позволяет легко объяснить наличие анизотропии его свойств.
Рассмотрим в качестве примера строение кристалла графита. Из рисунка 8.12 видно, что атомы углерода в кристалле графита располагаются в плоскостях, которые отстоят на определенных расстояниях друг от друга. Расстояния между атомами в плоскости в 2,5 раза меньше, чем расстояния между плоскостями. Поэтому атомы разных плоскостей связаны друг с другом слабее, чем атомы в одной плоскости. Отсюда следует, что разрушить кристалл так, чтобы плоскость разрыва была параллельна атомным плоскостям, легче, чем по какому-либо другому направлению. Действительно, кристаллы графита легко разрушаются (расслаиваются) благодаря тому, что атомы разных плоскостей скользят относительно друг друга. Когда мы пишем карандашом, такое расслоение происходит непрерывно и тонкие слои графита остаются на бумаге. Аналогично объясняется анизотропия других свойств.
|
|
|