|
|
|
|
Главная >> Молекулярная физика. Термодинамика. Физика 10 класс. Мякишев |
|
|
Глава 8. Твердые тела и их превращение в жидкости § 8.2. Кристаллическая решетка
Вследствие теплового движения расстояния между частицами несколько меняются, так как они совершают колебания около определенных точек — положений равновесия частиц. Именно эти точки (они называются узлами) и расположены в определенном порядке. В § 2.6 было введено понятие о кристаллической решетке как о пространственной решетке, которая получается, если узлы соединить прямыми линиями.
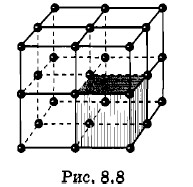
В пространственной решетке можно выделить наименьший фрагмент, повторением которого можно образовать всю решетку. Этот наименьший фрагмент называется элементарной ячейкой решетки. Так, элементарной ячейкой пространственной решетки кристалла криптона является куб (рис. 8.8). Длина ребра элементарной ячейки называется периодом кристаллической решетки. (Длины ребер элементарной ячейки могут быть различными по разным направлениям.) В монокристалле криптона такая ячейка повторяется много раз с неизменной ориентацией. На этом основании говорят, что в кристалле наблюдается дальний порядок в расположении атомов или других частиц (ионов, молекул и т. п.), из которых построен кристалл. Образно это можно себе представить так. Человек, уменьшенный до размеров атома, нашел бы, что путешествие в кристалле весьма однообразно. Перепрыгивая с атома на атом в каком-либо определенном направлении, он совершал бы прыжки одинаковой длины; расположение атомов справа и слева, над ним и под ним оставалось бы одним и тем же. Изменяя направление своего движения, человек быстро установил бы различие воспринимаемых картин. Он обнаружил бы, что расстояние между атомами изменилось, изменилось и их положение. Однако и новая картина повторялась бы до тех пор, пока он вновь не сменил бы направление перемещения. Четыре типа кристалловАлмаз и парафиновая свеча... Алмаз — символ твердости; парафин, подобно воску, мягок и податлив. Сразу можно подумать, что полярности свойств соответствует полярность сочленения в единое целое тех отдельных элементов, из которых состоят эти вещества. Подумав так, вы не ошибетесь. Парафин состоит из отдельных молекул, связанных друг с другом силами Ван-дер-Вааль- са (см. § 2.4). Кристалл алмаза можно рассматривать как одну гигантскую молекулу. Силы молекулярного притяжения значительно слабее химических сил, и соответственно парафин не идет ни в какое сравнение по твердости с алмазом. Существует четыре типа кристаллов: молекулярные, ковалентные (или атомные), ионные и металлические. Во всех типах кристаллов образующие их частицы (молекулы, атомы, ионы) располагаются таким образом, что их энергия оказывается минимальной. При таком расположении частиц внутри кристалла они образуют устойчивую систему. Молекулярные кристаллы
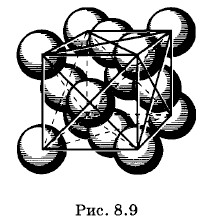
К молекулярным кристаллам относятся кристаллы водорода, аргона, азота, брома, нафталина и др. Сухой лед (твердая углекислота) и многие органические вещества также являются молекулярными кристаллами. Прочность всех этих кристаллов невелика. На рисунке 8.9 изображен молекулярный кристалл аргона. В отличие от изображений кристаллической решетки на рисунках 2.25 и 2.26, здесь атомы изображены не точками, а сферами. Кристалл имеет гранецентрированную кубическую структуру: в каждой элементарной ячейке атомы расположены в вершинах куба и в центрах его граней. Ковалентные кристаллыК ковалентным кристаллам относятся алмаз, полупроводники кремний и германий, а также многие соединения: сульфид цинка, оксид бериллия и др.
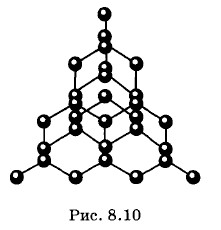
В алмазе число ближайших соседей каждого атома углерода равно его валентности, т. е. четырем. Атом располагается симметрично в центре группы из четырех одинаковых атомов, которые лежат в вершинах тетраэдра (рис. 8.10). Тетраэдр — фигура жесткая; его конфигурацию не изменишь, не деформируя его ребер. Куб же, к примеру, легко деформировать в параллелепипед, не меняя размеров ребер. Этим, а также малыми межатомными расстояниями (0,154 нм) объясняются свойства алмаза, в частности его уникальная твердость. Любые два соседних атома налаживают между собой ковалентную (парноэлектронную) связь, выделяя для этого по одному электрону. Но не надо думать, что коллективизированная пара принадлежит лишь двум атомам. От атома к соседям ведут четыре «тропинки» (связи), и данный валентный электрон может двигаться по любой из них. Дойдя до соседнего атома, он может перейти к следующему и блуждать по тропинкам-связям вдоль всего кристалла. Коллективизированные электроны принадлежат всему кристаллу в целом, и поэтому такой кристалл — это в сущности колоссальная молекула. Ковалентные связи алмаза очень прочны и не рвутся с увеличением энергии колебаний атомов, т. е. с ростом температуры. Поэтому алмаз не проводит электрический ток. Участвующие в связи атомов валентные электроны привязаны к кристаллической решетке, и внешнее электрическое поле не оказывает заметного влияния на их движение. Кристаллы кремния и германия подобны кристаллу алмаза, но у них парноэлектронные связи не столь прочны. Небольшое нагревание вызывает разрыв отдельных связей. Электроны покидают проторенные тропы и обретают свободу. Во внешнем электрическом поле они перемещаются между узлами решетки, образуя электрический ток. Подобного рода вещества называются полупроводниками. Подробно об этом будет рассказано в «Электродинамике».
|
|
|