|
|
|
|
|
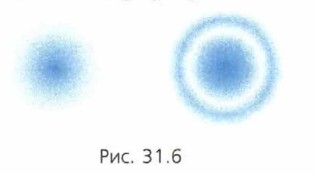
§ 31. Лазеры. Квантовая механика Корпускулярно-волновой дуализм (окончание)Слова «более вероятно» и «менее вероятно» часто используются в разговорном языке, и смысл этих слов понятен каждому. Учёные ввели количественную меру вероятности. Вероятность какого-либо события равна отношению числа случаев, в которых это событие происходит, к общему числу случаев. Например, событие, которое наступает каждый раз, имеет вероятность 1. А событие, которое происходит в половине всех возможных случаев, имеет вероятность 0,5 (скажем, выпадение монеты орлом). Событие же, которое не происходит никогда, имеет вероятность 0. С понятием вероятности мы встречались при изучении движения молекул газов. Например, определить скорость каждой молекулы газа в какой-либо момент времени невозможно. Однако пользуясь представлением о вероятности, можно вычислить среднюю кинетическую энергию молекул. Тщательный анализ опытов и теоретические исследования показали, что атомные процессы имеют в своей основе вероятностную природу. Поэтому физический смысл имеет только вероятность обнаружить электрон в данный момент времени в определённой точке пространства или вероятность того, что в данный момент времени скорость электрона равна определённому значению. Как же вероятностный характер атомных явлений объясняет сочетание волновых и корпускулярных свойств в одном объекте? Что представляют собой частицы-волны? Выяснилось, что «волны де Бройля» — это как бы «волны вероятности», определяющие вероятность обнаружить частицу в данной точке пространства: чем больше амплитуда волны, тем больше эта вероятность. Согласно квантовой механике движение частицы представляет собой распространение «волны вероятности». Поэтому и проявляются волновые свойства частиц, то есть явления интерференции и дифракции. Однако в любом опыте по обнаружению частицы она с определённой вероятностью оказывается целиком в одном месте пространства, то есть проявляет свойство корпускулы. На рисунке 31.6 схематически изображены некоторые «электронные волны» в атоме водорода: более тёмная окраска соответствует областям, в которых вероятность нахождения электрона больше. Рассматривая эти рисунки, учтите, что «электронная волна» определяет вероятность нахождения целого электрона в той или иной точке.
|
|
|