|
|
|
|
|
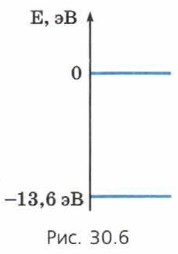
§ 30. Атомные спектры Энергетические уровни (окончание)Чтобы оторвать электрон от ядра, надо совершить положительную работу, потому что электрон притягивается к ядру. Следовательно, для удаления электрона от ядра надо увеличить его энергию. После этого увеличения энергии электрон станет свободным, и, если он будет покоиться, его энергия будет равна нулю. Значит, энергия электрона «до отрывания», то есть энергия связанного электрона, меньше нуля. На рисунке 30.6 в качестве примера изображён нулевой уровень энергии, соответствующий свободному электрону, а также уровень, соответствующий минимально возможной энергии электрона в атоме водорода (-13,6 эВ).
Чтобы «оторвать» электрон от ядра атома водорода, находящегося в основном состоянии, то есть превратить этот атом в положительно заряженный ион, необходимо сообщить электрону энергию, равную 13,6 эВ. Поэтому её называют энергией ионизации атома водорода. Принцип Паули и таблица МенделееваКогда учёные, изучив спектры излучения и поглощения атомов, нашли энергетические уровни электронов в атомах, выяснилось, что, даже когда атом находится в основном состоянии, далеко не все его электроны находятся на самом нижнем из возможных уровней. Оказалось, что электроны «заселяют» последовательно уровни, соответствующие всё большей и большей энергии. И возник вопрос: почему же все электроны атома, излучив фотоны, не «падают» на один и тот же самый нижний уровень? Ответ нашёл швейцарский физик В. Паули. Он предположил, что электроны подчиняются принципу запрета, который назвали впоследствии принципом Паули. Согласно принципу Паули на каждом уровне в атоме может находиться не более двух электронов. Принцип Паули позволил понять природу периодической системы химических элементов (таблицы Менделеева).
|
|
|