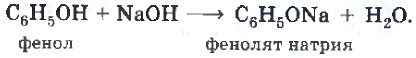|
|
|
|
|
Глава 2. Кислород- и азотсодержащие органические соединения и их природные источники § 10. ФенолФункциональную гидроксильную группу содержат не только спирты, но и другой класс органических соединений, которые называют фенолами. У веществ этого класса гидроксил связан не с алкильным радикалом, а с фенилом, т. е. ароматическим радикалом.
Простейшим представителем этого класса органических соединений является фенол С6Н5ОН (рис. 42). Фенол раньше получали взаимодействием хлорбензола со щелочью в очень жестких условиях (высокие температура и давление): С6Н5Сl + NaOH---> С6Н5ОН + NaCl. В настоящее время одним из важнейших способов получения фенола является прямое окисление бензола. Одним из основных источников для промышленного получения фенола является каменный уголь. Каменный уголь представляет собой окаменелые останки доисторических растений. Наряду с природным газом и нефтью, он является важнейшим сырьевым источником химических веществ. Запасы каменного угля на планете значительно превышают запасы газа и нефти (рис. 43), поэтому химическое производство, основанное на переработке угля (коксохимическое производство), имеет большое будущее.
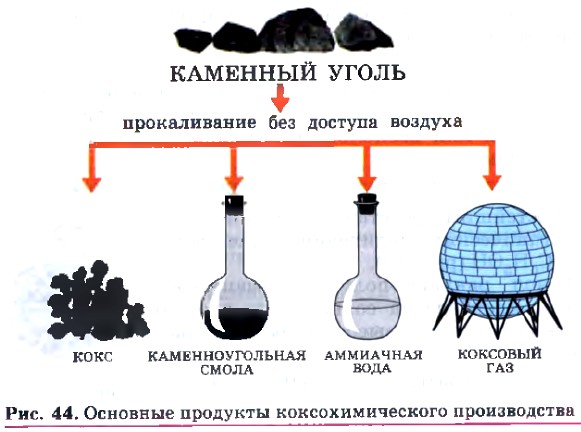
Коксохимическое производство (рис. 44) основано на нагревании каменного угля в специальных установках, называемых коксовыми батареями, без доступа воздуха. В результате коксования, которое проводят при температуре около 1000 °С, получают: Фенол представляет собой белые игольчатые кристаллы с характерным запахом, быстро розовеющие на воздухе в результате окисления. Он малорастворим в холодной воде, но неограниченно — в горячей. До сих пор используют исторически сложившееся название этого вещества — карболовая кислота. Химические свойства фенола обусловлены сочетанием двух фрагментов в составе его молекулы: ароматического углеводородного радикала фенила и гидроксильной группы. Свойства фенола являются яркой иллюстрацией положения теории строения органических соединений о взаимном влиянии атомов в молекулах. Влияние фенила на гидроксил заключается в том, что он еще более поляризует ковалентную связь между атомами кислорода и водорода в гидроксиле. Атом водорода при этом становится более подвижным по сравнению со спиртами, что обусловливает кислотные свойства фенола (отсюда и название — карболовая кислота): С6Н5—O← H. Поэтому, в отличие от спиртов, фенол вступает в реакцию нейтрализации со щелочами, например:
Подобно алкоголятам, фенолят натрия может быть получен и при взаимодействии фенола с металлическим натрием:
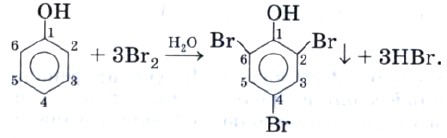
Влияние гидроксила на фенил состоит в том, что он делает атомы водорода в положениях 2, 4 и б более подвижными, и потому фенол, в отличие от бензола, взаимодействует с бромной водой, образуя белый осадок 2,4,6-трибромфенол:
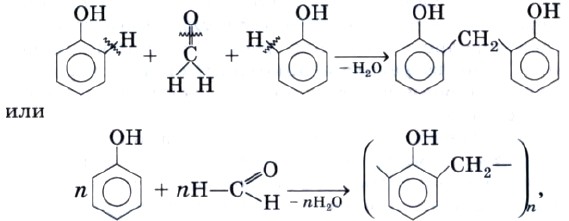
Эта реакция служит для качественного обнаружения фенола. Из-за подвижности атомов водорода в положениях 2 и 6 фенол способен вступать в реакцию поликонденсации с формальдегидом с образованием фенолоформальдегидной смолы:
которая является основой для производства ценнейшей фенолоформальдегидной пластмассы.
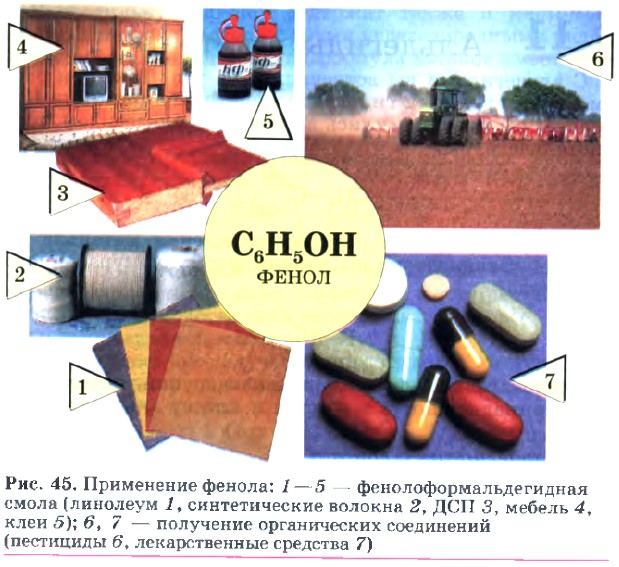
Фенолоформальдегидную смолу широко используют для производства древесностружечных плит (ДСП), фанеры, электротехнических приборов, бытовых предметов. Мебель, изготовленная из ДСП, выделяет в атмосферу квартир и домов немалое количество фенола, который очень вреден для здоровья, поэтому комнаты с такой мебелью надо проветривать, а лучше — дать отстояться новой мебели в нежилом помещении с открытым окном. Фенол находит широкое применение в различных отраслях промышленности (рис. 45).
1. Какие вещества называют фенолами? 2. Почему фенол называют также карболовой кислотой? 3. В чем проявляется взаимное влияние фенила и гидроксила друг на друга в молекуле фенола? 4. Какие свойства фенола лежат в основе его применения? 5. Из 390 г бензола в две стадии было получено 410 г фенола. Определите массовую долю выхода продукта реакции от теоретически возможного. 6. При взаимодействии фенола с бромной водой образуется нерастворимый в воде 2,4,6-трибромфенол (качественная реакция на фенол). При действии избытка бромной воды на 240 г водного раствора фенола получено 8,45 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
|
|
|