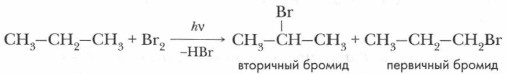|
|
|
|
|
Глава 5. Углеводороды § 12. Химические свойства алканов и их применение
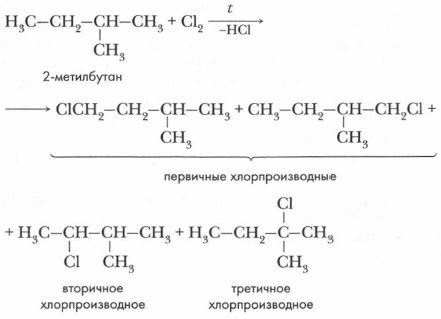
Явление гомологии в химии имеет важное значение. Оно помогает нам изучить свойства целого класса соединений. Достаточно знать свойства одного представителя гомологического ряда и закономерности изменения свойств гомологов при увеличении их относительной молекулярной массы, чтобы сделать выводы о свойствах других гомологов. Рассмотрим химические свойства предельных углеводородов. Проблема. Предельные углеводороды являются малоактивными и имеют еще одно название — парафины (от лат. рагит — «мало»; ajfinis — «родство»). В химические реакции парафины вступают при сильном нагревании или под действием света, даже с самыми активными веществами. Почему? Давайте попытаемся ответить на этот вопрос. 1. Реакции замещения. Атом углерода в предельных углеводородах находится в состоянии sp3-гибридизации. Это значит, что химические реакции, в которые они вступают, связаны с разрывом весьма прочных σ-связей(С—С и С—Н). Кроме того, эти связи характеризуются очень низкой поляризуемостью. Поэтому разрыв связи требует больших затрат. Для алканов характерны реакции радикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-нибудь группу атомов. Примером может служить реакция с хлором, при которой происходит последовательное замещение атомов водорода на атомы хлора под действием света или нагревания.
Подобные реакции представляют собой цепь последовательных превращений, т. е. они имеют цепной характер (подробнее с механизмом цепной реакции вы познакомитесь позднее). В разработку теории цепных реакций большой вклад внес отечественный физик, академик, лауреат Нобелевской премии Н.Н. Семенов.
В этой реакции образуется смесь хлорпроизводных. Соотношение первичных, вторичных и третичных монохлорпроизводных составляет приблизительно 9:2:1.
При более низкой температуре хлорирование протекает с большей избирательностью. Соотношение продуктов реакции согласуется с относительной реакционной способностью связей С—Н у третичных, вторичных и первичных атомов углерода. Бромирование алканов протекает в отличие от хлорирования с высокой избирательностью. Сначала происходит отрыв атома водорода от третичного атома углерода, затем от вторичного и, наконец, от первичного:
Соотношение вторичного и первичного монобромидов составляет 50:1.
С фтором алканы реагируют со взрывом, хлорирование и бромирование требуют инициирования. Взаимодействие с иодом обратимо, поэтому иодирование проводят в присутствии окислителя для удаления иодоводорода. Проблема. Как объяснить то, что в реакциях радикального замещения (галогенирования) алканов легче всего замещаются атомы водорода у третичных, а затем у вторичных и первичных атомов углерода? Это связано с уменьшением энергии связей С—Н в простейших алканах. В этане она составляет 417 кДж/моль, для звена СН2 в пропане — 396 кДж/моль, в изобутане для звена СН — 376 кДж/моль.
|
|
|



 Какие углеводороды называются предельными, или насыщенными, и почему они так называются? В каком валентном состоянии находится каждый атом углерода в предельных углеводородах?
Какие углеводороды называются предельными, или насыщенными, и почему они так называются? В каком валентном состоянии находится каждый атом углерода в предельных углеводородах?


 При высоких температурах (> 400 °С) хлор вступает в реакцию замещения и с другими гомологами метана. При этом атом хлора реагирует неизбирательно и связывается с любым из сталкивающихся с ним атомов водорода:
При высоких температурах (> 400 °С) хлор вступает в реакцию замещения и с другими гомологами метана. При этом атом хлора реагирует неизбирательно и связывается с любым из сталкивающихся с ним атомов водорода: