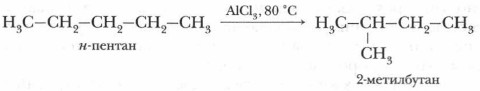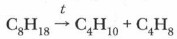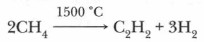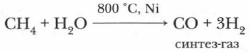|
|
|
|
|
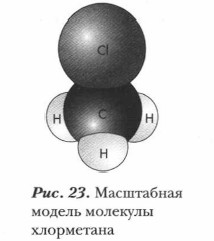
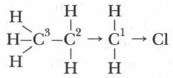
Глава 5. Углеводороды Химические свойства алканов и их применениеВ реакции галогенирования образуются вещества, которые называются галогеноуглеводородами. Они являются одними из важнейших соединений в органическом синтезе. Реакционная способность галогеноалканов определяется характером связи углерод — галоген и структурой молекулы. В случае хлорирования метана в хлорметане образуется связь С—Сl, в результате чего молекула принимает форму неправильного тетраэдра (вытянутого в одну сторону), в котором валентный угол Н—С—Сl несколько больше идеального. Связь С—Сl значительно длиннее связи С—Н (соответственно 0,176 и 0,109 нм) и более полярна (рис. 23).
Электронная плотность связи С—С1 в молекуле хлорэтана смещена к атому хлора. В результате атом углерода, связанной с атомом хлора, притягивает электронную плотность связи с соседним атомом углерода, и на нем скапливается частичный отрицательный заряд, а на соседнем атоме углерода — частичный положительный заряд:
В итоге электронная плотность в молекуле хлорэтана по сравнению с молекулой этана смещена в сторону атома хлора. Связь углерод-углерод становится полярной. Полярность одной ковалентной связи является причиной смещения электронной плотности соседних σ-связей в сторону атома более электроотрицательного элемента.
Если атом или группа атомов смещает электронную плотность от атома углерода по σ-связи, то этот атом или группа атомов обладают отрицательным индуктивным эффектом (-I). Атом хлора притягивает к себе электронную плотность ковалентной связи, является акцептором электронов. Он оказывает отрицательный индуктивный эффект (-I). Такой эффект проявляют более электроотрицательные, чем углерод, атомы. Если электронная плотность на атоме углерода возрастает (метильная или этильная группа для атома углерода, является донором), то он обладает положительным индуктивным эффектом (+I). Смещение электронной плотности обозначают прямыми стрелками. Атом углерода метальной группы, на котором создается дефицит электронной плотности, стремится компенсировать свой заряд, оттягивая электронную плотность от соседних атомов водорода. Связи С—Н в хлорметане становятся менее прочными, атомы водорода легче замещаются на атомы хлора, чем первый атом водорода в молекуле метана. Например, влияние атома хлора в молекуле 1-хлорпропана на третий атом углерода практически не сказывается:
При увеличении углеводородного радикала индуктивный эффект в цепочке атомов быстро затухает. Влияние атомов в молекуле взаимно. Радикал (метил), в свою очередь, влияет на атом хлора: метан не взаимодействует с водой, а хлорметан вступает в реакцию гидролиза:
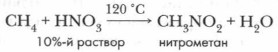
Впервые реакцию нитрования алканов провел русский химик М.И. Коновалов в 1 888 г. Эта реакция носит его имя. Реакция нитрования, как и реакция галогенирования, идет по свободнорадикальному механизму. Нитроалканы используются для получения взрывчатых веществ и ракетного топлива.
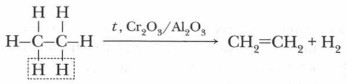
2. Дегидрирование (реакция отщепления). В этой реакции от молекулы алкана отщепляется молекула водорода. Дегидрирование протекает в присутствии катализаторов (Ni, Pd) при повышенной температуре, при этом образуются этиленовые углеводороды.
3. Реакция изомеризации (перегруппировки). При нагревании алканов нормального строения в присутствии катализатора хлорида алюминия АlСl3 происходит образование углеводородов разветвленного строения. Такая реакция получила название реакции изомеризации.
4. Реакция разложения. а) При высокой температуре происходит разложение предельных углеводородов — крекинг (от англ, cracking — «расщепление»). Крупные молекулы алканов превращаются в вещества с более короткой цепью атомов углерода. Если процесс проводится в присутствии катализатора, то крекинг называется каталитическим, без катализатора — термическим. Более подробно с этим процессом вы познакомитесь в § 54. Продуктом реакции является смесь предельных и непредельных углеводородов:
б) При нагревании алканов до 1000 °С происходит разложение на простые вещества: углерод и водород — пиролиз.
в) При нагревании до 1500 °С происходит образование ацетилена и водорода:
г) Конверсия метана. При взаимодействии метана с нагретым водяным паром в присутствии никелевого катализатора образуется смесь оксида углерода (II) и водорода, называемая синтез-газом. Его используют для получения синтетического бензина и кислородсодержащих органических соединений.
|
|
|



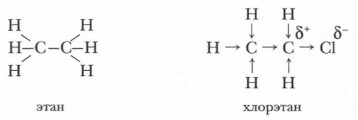
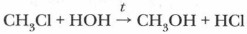
 Нитрование. Предельные углеводороды не взаимодействуют с кислотами при обычной температуре, даже с концентрированными. Однако при нагревании и небольшом повышении давления алканы вступают в реакцию замещения с разбавленной азотной кислотой. В результате этой реакции происходит замещение атома водорода в молекуле алкана на нитрогруппу —NO2.
Нитрование. Предельные углеводороды не взаимодействуют с кислотами при обычной температуре, даже с концентрированными. Однако при нагревании и небольшом повышении давления алканы вступают в реакцию замещения с разбавленной азотной кислотой. В результате этой реакции происходит замещение атома водорода в молекуле алкана на нитрогруппу —NO2.