|
|
|
|
|
Глава 5. Углеводороды § 15. Алкены. Свойства, применение и получение (окончание)2. Реакции окисленияа) Горение. Экзотермическая реакция, протекающая с выделением большого количества теплоты.
б) Окисление перманганатом калия (реакция Вагнера). При мягком окислении этилена и его гомологов происходит разрыв π-связи, и малиновая окраска раствора перманганата калия КМп04 исчезает. Эта реакция была открыта в 1888 г. русским химиком Е.Е. Вагнером, и носит его имя. Она также является ачественной реакцией на алкены.
При частичном окислении — пропускании смеси этилена с воздухом над серебряным катализатором при нагревании до 350 °С образуется оксид этилена:
Оксид этилена используется для производства различных органических веществ (уксусного альдегида, лаков, пластмасс, волокон, синтетических каучуков и т. д.).
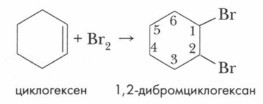
Циклоалкены. В цикле этих соединений имеется одна двойная связь:
Эти вещества по свойствам напоминают алкены. Для них характерны реакции присоединения:
Задание. Предположите, в какие реакции вступит циклопентен. Запишите уравнения предполагаемых химических реакций. Получение алкенов в лабораторииВ лабораторных условиях этилен получают при нагревании смеси этилового спирта с концентрированной серной кислотой до температуры 140 °С.При взаимодействии галогеналкана со спиртовым раствором щелочи происходит отщепление галогеноводорода и образуется соответствующий алкен.
Промышленные способы получения алкенов1. Дегидрирование алкановЭто основной источник получения алкенов в промышленности. Процесс проводят при температуре до 450 °С и в присутствии катализатора — оксида хрома (III):
2. Крекинг алканов
Основные понятия Реакции присоединения. Полимеризация. Реакция Вагнера. Правило Марковникова. Циклоалкены. Дегидрирование и крекинг Вопросы и задания
С2Н6 → С2Н5Вr → С2Н4 → (—СН2—СН2—)n
|
|
|



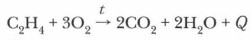
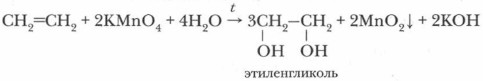
 Лабораторный опыт. В пробирку с раствором перманганата калия пропустим этилен. Что вы наблюдаете?
Лабораторный опыт. В пробирку с раствором перманганата калия пропустим этилен. Что вы наблюдаете?
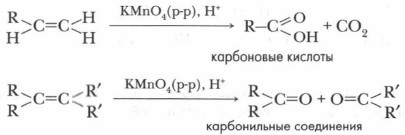
 При жестком окислении алкенов происходит разрыв и π- и σ-связей, образуются карбоновые кислоты и карбонильные соединения.
При жестком окислении алкенов происходит разрыв и π- и σ-связей, образуются карбоновые кислоты и карбонильные соединения.
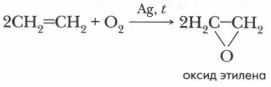

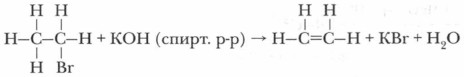
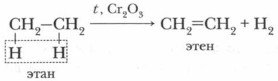
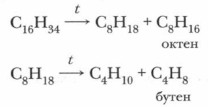
 1. Почему алкены более реакционноспособны, чем алканы?
1. Почему алкены более реакционноспособны, чем алканы?
 2. В двух колбах находятся газы: бутилен и циклобутан. Как распознать эти газы?
2. В двух колбах находятся газы: бутилен и циклобутан. Как распознать эти газы?
 3. Какие изменения происходят в строении молекулы этилена при присоединении к ней молекулы хлора?
3. Какие изменения происходят в строении молекулы этилена при присоединении к ней молекулы хлора?
 7. Составьте схему применения этилена и запишите три уравнения химических реакций, отражающие различные аспекты применения.
7. Составьте схему применения этилена и запишите три уравнения химических реакций, отражающие различные аспекты применения.