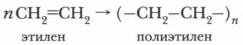|
|
|
|
|
Глава 5. Углеводороды Алкены. Свойства, применение и получениеПроблема. Мы рассмотрели присоединение сложных веществ (НСl, Н2O) к симметричной молекуле этилена. А как пойдет присоединение хлороводорода к гомологам этилена несимметричного строения, например к пропилену?
Для этого рассмотрим механизм реакции присоединения. Хлороводород НСl — полярное соединение. Атом водорода имеет частичный положительный заряд, атом хлора — частичный отрицательный заряд:
При сближении молекул хлороводорода и пропена происходит разрыв связи Н—Сl и образуются ионы:
Положительно заряженный ион водорода (протон) — электрофильная частица атакует молекулу алкена, при этом π-связь поляризуется быстрее σ-связи и разрывается. Электрофил присоединяется к звену СН2, так как здесь скапливается бо́льший отрицательный заряд и образуется органический ион — карбокатион:
Карбокатион часто называют σ-комплексом, поскольку при его образовании формируется новая σ-связь. К карбокатиону затем присоединяется хлорид-ион и образуется 2-хлор- пропан:
В реакциях присоединения галогеноводородов, воды к гомологам этена наблюдается определенный путь, по которому идет эта реакция.
Закономерности подобных реакций, которые носят название правила Марковникова, экспериментально доказал русский ученый В. В. Марковников.
Задание. Запишите уравнение химической реакции взаимодействия пропилена с бромоводородом. Дайте название полученному продукту. д) Полимеризация Проблема. Выскажите свои соображения по поводу того, могут ли молекулы этилена и его гомологи взаимодействовать друг с другом. При повышенной температуре, давлении и в присутствии катализатора молекулы этиленовых углеводородов могут соединяться между собой в длинные цепи за счет разрыва π-связей. Это схематично можно изобразить так: СН2=СН2 + СН2=СН2 → —СН2—СН2—СН2—СН2—
Образуется высокомолекулярное вещество.
Сокращенное уравнение реакции полимеризации можно представить следующим образом:
Аналогичный способ краткого написания формулы полимеров применяется и для других полимерных соединений. Продуктом реакции полимеризации этилена является полимер — полиэтилен. Исходное вещество (этилен) — мономер, повторяющееся звено (в данном случае — СН2—СН2—) — элементарное, или структурное, звено. Коэффициент n — количество молекул мономера, индекс n — степень полимеризации. Полимеры — механически прочный материал. Они широко используются в промышленности. Изделия из них газо- и влагонепроницаемы, не проводят электрический ток. При обычных условиях на них не действуют органические растворители, они устойчивы к действию концентрированных кислот и щелочей. Позже мы более подробно познакомимся со свойствами этих веществ и механизмом ракции полимеризации (см. с. 333).
|
|
|



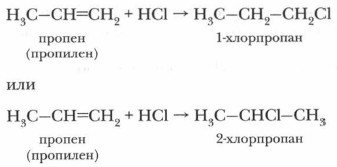
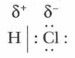
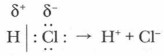
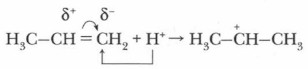
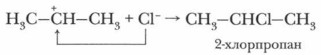
 Таким образом, механизм реакции присоединения условно слагается из трех стадий. Вначале разрывается связь Н—Сl с образованием неорганических ионов, затем образуется положительно заряженный органический ион — карбокатион Н3С—+СН—СН3 и наконец — нейтральный продукт реакции СН3—СНСl—СН3. Такой механизм реакции называется электрофильным присоединением. Аналогично происходит присоединение к алкенам молекул воды.
Таким образом, механизм реакции присоединения условно слагается из трех стадий. Вначале разрывается связь Н—Сl с образованием неорганических ионов, затем образуется положительно заряженный органический ион — карбокатион Н3С—+СН—СН3 и наконец — нейтральный продукт реакции СН3—СНСl—СН3. Такой механизм реакции называется электрофильным присоединением. Аналогично происходит присоединение к алкенам молекул воды.