|
|
|
|
|
Глава 7. Спирты, фенолы § 26. Фенолы
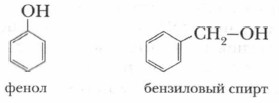
Фенолы не следует путать с ароматическими спиртами. У фенолов гидроксильная группа непосредственно связана с углеродным атомом бензольного кольца. У ароматических спиртов бензольное кольцо отделено от гидроксильной группы одним или несколькими насыщенными углеродными атомами, например:
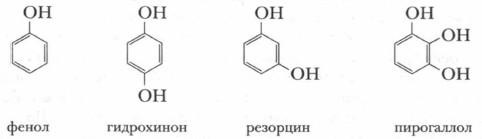
В зависимости от числа функциональных групп фенолы делятся на одноатомные, двухатомные, трехатомные и др. Приведем примеры.
Правила IUРАС допускают наряду с международными названиями (например, фенол называется гидроксибензолом) использовать тривиальные, поскольку они широко применяются на практике: фенол, гидрохинон, резорцин и др. Простейшим и наиболее известным представителем этого класса соединений является фенол. Его молекулярная формула С6Н5—ОН. Радикал фенола С6Н5— называется фенил. Фенол был впервые обнаружен в 1834 г. в каменноугольном дегте, из которого получали светильный газ. Отсюда и его название: по гречески phaino — «освещаю». Фенол известен человеку с начала XIX в. Во второй половине XIX в. он уже использовался в больницах как дезинфицирующее вещество под названием карболовая кислота. Особенности строения молекулы фенолаВспомните строение бензола, особенности связей и распределение электронной плотности в бензольном кольце. Если в бензоле один атом водорода заменить на группу —ОН, получим фенол.
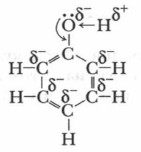
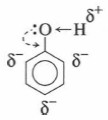
Гидроксильная группа в феноле непосредственно связана с атомом углерода углеводородного радикала фенила, который оказывает на нее влияние. В отличие от радикалов предельных углеводородов, являющихся донорами электронов, бензольное кольцо, точнее, его радикал С6Н3—, называемый фенилом, обладает особенностью оттягивать к себе электроны, в данном случае — от атомов кислорода гидроксильной группы —ОН. Это приводит к появлению на атоме водорода гидроксильной группы положительного заряда, что делает его более подвижным по сравнению с атомом водорода в группе —ОН спиртов, а само вещество фенол приобретает кислотные свойства.
В свою очередь, гидроксильная группа оказывает влияние на радикал. Под влиянием функциональной группы —ОН в бензольном кольце фенола электронная плотность распределяется неравномерно: частичный отрицательный заряд сосредоточен у атомов углерода, находящихся в 2,4,6-положениях. Это облегчает реакции замещения атомов водорода бензольного кольца именно в указанных положениях. В результате реакций замещения получают 2,4,6-производные фенола.
На примере фенола хорошо видно взаимное влияние атомов в молекуле и, в частности, влияние функциональной группы и радикала друг на друга.
Физические свойства фенолаФенол — твердое бесцветное кристаллическое вещество, низкоплавкое, очень гигроскопичное, с характерным запахом. На воздухе фенол окисляется, поэтому его кристаллы приобретают вначале розоватый оттенок, а при длительном хранении темнеют и становятся более красными. Он малорастворим в воде при комнатной температуре, но быстро и хорошо растворяется при 60—70 °С. Фенол легкоплавок, его температура плавления 43 °С. Фенол обладает антисептическими (обеззараживающими) свойствами.
|
|
|



 Какие ароматические соединения вам известны? Изобразите формулу бензола и укажите особенности его строения. Запишите уравнения реакций, характерных для бензола, и укажите условия их протекания.
Какие ароматические соединения вам известны? Изобразите формулу бензола и укажите особенности его строения. Запишите уравнения реакций, характерных для бензола, и укажите условия их протекания.
 Кислотность фенола значительно выше (на 5-6 порядков), чем кислотность спиртов. Водный раствор фенола называют карболовой кислотой. Однако кислотные свойства у нее выражены слабо (более слабая кислота, чем угольная), она не изменяет окраску лакмуса.
Кислотность фенола значительно выше (на 5-6 порядков), чем кислотность спиртов. Водный раствор фенола называют карболовой кислотой. Однако кислотные свойства у нее выражены слабо (более слабая кислота, чем угольная), она не изменяет окраску лакмуса.
 Демонстрационный опыт. В пробирку нальем 3 мл Н2O и добавим шпателем несколько кристалликов фенола. Смесь встряхнем. Раствор мутнеет, на дне пробирки остаются кристаллы. Пробирку слегка нагреем (до растворения кристаллов). Что вы наблюдаете? Почему раствор стал прозрачным? Затем содержимое пробирки охладим. Что вы наблюдаете? Сделайте выводы.
Демонстрационный опыт. В пробирку нальем 3 мл Н2O и добавим шпателем несколько кристалликов фенола. Смесь встряхнем. Раствор мутнеет, на дне пробирки остаются кристаллы. Пробирку слегка нагреем (до растворения кристаллов). Что вы наблюдаете? Почему раствор стал прозрачным? Затем содержимое пробирки охладим. Что вы наблюдаете? Сделайте выводы.