|
|
|
|
|
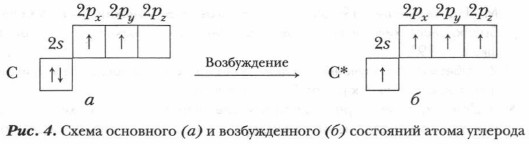
Глава 3. Особенности строения и свойств органических соединений. Их классификация § 5. Электронное и пространственное строение органических соединенийПри изучении органической химии важно опираться не только на общие фундаментальные теории, законы и понятия химии. Необходимо учитывать индивидуальность каждого изучаемого соединения, особенности его строения и свойств. Единство всеобщего — особенного — индивидуального, взаимосвязь строения и свойств, генетические связи органических соединений разных классов и видов — таковы принципы, которых мы будем придерживаться при изучении органической химии. Для этого надо хорошо знать не только химическое, но также электронное и пространственное строение изучаемых веществ, и на этой основе предсказывать, моделировать и объяснять их свойства, их химические реакции. Поскольку атомы углерода присутствуют во всех органических веществах, вновь обратимся к электронной структуре атома углерода (рис. 4).
На внешнем электронном слое атома углерода имеется два спаренных s-электрона и два неспаренных р-электрона, которые являются валентными, т. е. способными образовывать две ковалентные связи с сохранением пары электронов на s-орбитали. Однако атом углерода из основного (а) состояния способен перейти в возбужденное (б) состояние, что связано с распариванием s-электронов и переходом одного из них с 2s- на 2р-орбиталь. Проблема. Почему возможен процесс возбуждения атома углерода, за счет каких энергетических ресурсов?
Задание. Рассчитайте выигрыш в энергии при образовании одного моля метана с учетом перехода атомов углерода в возбужденное состояние. Органические соединения образованы с помощью ковалентных связей. Ковалентные связи в молекулах органических веществ характеризуются: энергией, длиной, насыщаемостью и пространственной направленностью. Из курса химии 8 класса вы знаете, что образование из атомов молекул с ковалентной связью сопровождается выделением энергии, такие молекулы устойчивы. Энергия связи указывает на ее прочность и измеряется в килоджоулях на 1 моль (кДж/моль). Чем выше температура, тем больше энергии выделяется при образовании связи, а следовательно, тем прочнее химическая связь.
Длина связи определяется расстоянием между центрами ядер связывающихся атомов. Она измеряется в нанометрах (1 нм = 10-9 м) или в ангстремах Под насыщаемостью связи понимают способность атомов углерода образовывать строго определенное число ковалентных связей. Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. При последующем изучении разных классов органических соединений мы будем говорить об этом подробнее.
|
|
|



 Переход атома в возбужденное состояние сопряжен с поглощением энергии, что затем с избытком компенсируется процессом образования химических связей атомом углерода. Например, при образовании одного моля метана избыток энергии равен 1 662 кДж. Углерод в возбужденном состоянии способен образовывать уже четыре ковалентные связи. В органических соединениях углерод четырехвалентен. Так, при образовании каждого моля связи С—Н выделяется 415,5 кДж, а их в метане четыре.
Переход атома в возбужденное состояние сопряжен с поглощением энергии, что затем с избытком компенсируется процессом образования химических связей атомом углерода. Например, при образовании одного моля метана избыток энергии равен 1 662 кДж. Углерод в возбужденном состоянии способен образовывать уже четыре ковалентные связи. В органических соединениях углерод четырехвалентен. Так, при образовании каждого моля связи С—Н выделяется 415,5 кДж, а их в метане четыре.
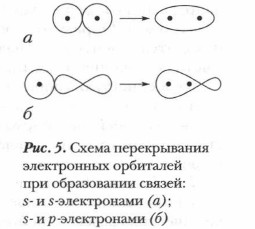
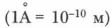 и зависит от природы атомов и характера связи между ними (одинарная, двойная, тройная). С повышением кратности связи ее длина становится меньше.
и зависит от природы атомов и характера связи между ними (одинарная, двойная, тройная). С повышением кратности связи ее длина становится меньше.