|
|
|
|
|
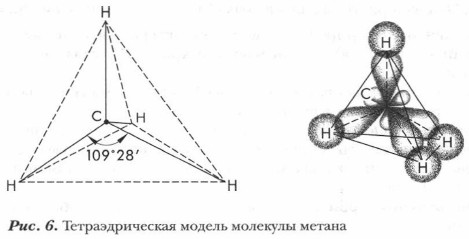
Глава 3. Особенности строения и свойств органических соединений. Их классификация Электронное и пространственное строение органических соединенийГибридизация атомных орбиталейВы уже знаете, что возбужденный атом углерода имеет на внешнем энергетическом уровне четыре валентных электрона. Один из них является 2s-электроном, имеющим сферическую конфигурацию облака, и три — 2р-электронами, электронные облака которых имеют форму гантели и расположены под углом 90°. Вследствие этого можно предположить, что четыре ковалентные связи атома углерода, которые он образует с водородом в молекуле метана, будут неравноценными: одна связь образована его s-электроном и три связи — р-электронами. Однако экспериментально доказано, что в действительности все связи С—Н в метане равноценны и направлены к вершинам правильного тетраэдра под углом 109°28'. При образовании связей электронные облака перекрываются, s- и р-орбитали атома смешиваются и образуют гибридные электронные облака. Так происходит процесс гибридизации. Рассмотрим его механизм на примере метана. В возбужденном атоме углерода при образовании ковалентных связей одна s- и три р-орбитали гибридизируются. Они образуют четыре равноценных, смешанных, или гибридных, облака с одинаковой формой и энергией. Симметрично расположенные в пространстве гибридные sр3-орбитали направлены в пространстве под одинаковым углом, равным 109° 28' вытянуты по направлению к вершинам тетраэдра. Каждая орбиталь заполняется одним электроном. Образуются ковалентные связи С—Н. Атом углерода как бы находится в центре тетраэдра или правильной четырехгранной пирамиды, а четыре соединенных с ним атома водорода — в ее вершинах (рис. 6).
Особенностью гибридных орбиталей является то, что их электронная плотность по одну сторону ядра значительно больше, чем по другую. Следовательно, грушевидная форма орбиталей атома углерода обеспечивает большую степень перекрывания электронных облаков при образовании ковалентных связей с другими атомами. Проблема. Почему электронные облака атома углерода гибридизируются? Гибридизация атомных орбиталей происходит в момент образования химических связей и требует затраты энергии, которая с избытком окупается в результате образования прочных химических связей атома углерода с другими атомами. Гибридизация орбиталей выгодна в энергетическом плане.
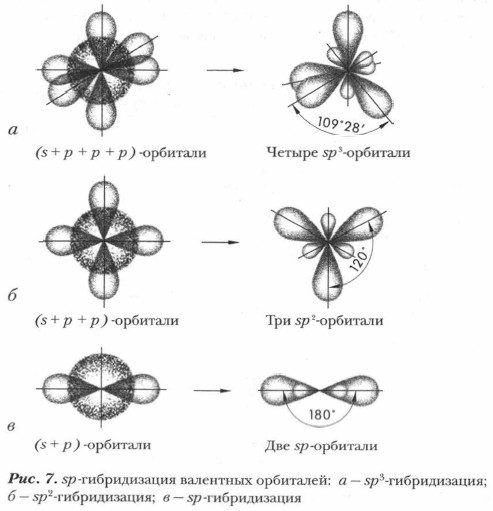
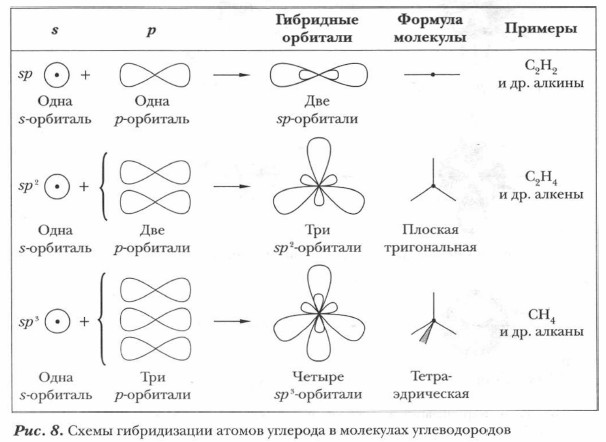
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном из трех состояний гибридизации: sp3, sp2 и sp (рис. 7, 8). 2) sp2-гибридизация осуществляется при смешивании одной s- и двух p-орбиталей возбужденного атома углерода. Образуются три гибридизированные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120° (см. рис. 7, б). Негибридизированная орбиталь находится в перпендикулярной плоскости. Атом углерода в состоянии sp2-гибридизации имеет электронную конфигурацию 1s2(2sp2)32p. Такой атом углерода характерен для ненасыщенных углеводородов — алкенов (например, для этилена) и соответствующих им радикалов, а также для некоторых функциональных групп (например, карбонильной, карбоксильной и др.) и неорганических соединений (BF3 и др.).
3) sp-гибридизация происходит при смешивании одной s- и одной p-орбиталей возбужденного атома углерода. Образуются две равноценные sp-гибридные атомные орбитали, расположенные линейно под углом 1 80° и направленные в разные стороны от ядра атома углерода (см. рис. 7, в). Две оставшиеся негибридизированные р-орбитали располагаются во взаимно перпендикулярных плоскостях. Такое состояние гибридизации характерно для соединений, имеющих тройную ковалентную связь, например в ацетилене и других алкинах, в ВеСl2 и др.
В гибридизированном состоянии могут находиться и атомы других элементов. Например, атом азота в ионе аммония NH +4 находится в состоянии sр3-гибридизации. Задание. Вспомните геометрическое строение молекул фтороводорода, аммиака и воды. Запишите их электронные формулы. Сравните строение молекул аммиака и метана. В чем их сходство?
Дважды лауреат Нобелевской премии Л. Полинг предложил идею гибридизации для объяснения пространственного (т. е. геометрического) строения молекул и ионов с учетом направленности ковалентной связи (т. е. их формы). Орбитали и их гибридизация — это лишь модельные представления квантовой химии, удобные для объяснения геометрии молекул. Особое положение элемента углерода в IVA-группе периодической системы, уникальное соотношение заряда ядра и радиуса (оба имеют небольшие значения), а также равенство числа валентных электронов числу валентных орбиталей обусловливает его способность соединяться с другими атомами углерода в цепи, одинаково легко присоединять и отдавать электроны.
|
|
|



 1) sp3-гибридизация происходит при смешивании одной s- и трех р-орбиталей. Возникают четыре одинаковые электронные орбитали, расположенные относительно друг друга под тетраэдрическими углами 109° 28' (рис. 7, а). Мы уже рассматривали выше sр3-гибридизацию на примере атома углерода в молекуле метана. Такое состояние гибридизации характерно для атомов углерода в насыщенных углеводородах (см. учебник химии для 9 класса).
1) sp3-гибридизация происходит при смешивании одной s- и трех р-орбиталей. Возникают четыре одинаковые электронные орбитали, расположенные относительно друг друга под тетраэдрическими углами 109° 28' (рис. 7, а). Мы уже рассматривали выше sр3-гибридизацию на примере атома углерода в молекуле метана. Такое состояние гибридизации характерно для атомов углерода в насыщенных углеводородах (см. учебник химии для 9 класса).