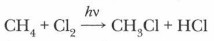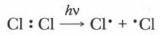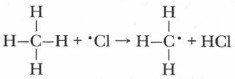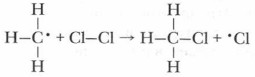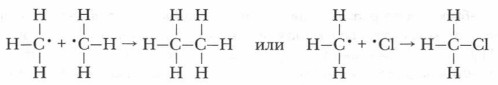|
|
|
|
|
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений Особенности органических реакций. Механизм реакцийСначала образуется хлорметан:
Затем при избытке хлора реакция может идти по стадиям последовательного замещения других атомов водорода с образованием хлорзамещенных метана: дихлорметана СН2Сl2, трихлорметана СНСl3, тетрахлорметана ССl4, т. е. до тех пор, пока все атомы водорода в молекуле метана не будут замещены на атомы хлора. Подобная реакция замещения может происходить и с другими алканами, причем в их молекулах атомы водорода могут замещаться не только атомами хлора, но и атомами других галогенов.
Большинство органических реакций и практически все биохимические реакции — сложные. Механизм реакции служит основой одной из классификаций реакций в органической химии. Рассмотрим механизмы реакций подробнее. Механизм реакции хлорирования метана (реакции замещения)В осуществлении реакции большая роль принадлежит энергетике связей между атомами в органических соединениях. У реагентов: метана и хлора энергия связи между их атомами различна: энергия связи Cl—Сl в молекуле хлора равна 240 кДж/моль, в молекуле метана энергия связи С—Н 415 кДж/моль, следовательно, при определенных условиях (при поглощении световой или тепловой энергии), прежде всего будет разрываться связь в молекуле Сl2.
Образуются атомы хлора, имеющие один неспаренный электрон и большой запас энергии. Они атакуют молекулу метана, захватывая и присоединяя к себе его атом водорода:
Образуется свободный метильный радикал •СН3, также имеющий один неспаренный электрон и обладающий большим запасом энергии, способный разорвать связь в молекуле хлора и связаться с одним атомом хлора, образуя устойчивую молекулу хлорметана и свободный радикал хлора:
Радикал хлора (атом хлора с неспаренным электроном) реагирует со следующей молекулой метана и т. д. Этот процесс продолжается до тех пор, пока будет идти образование свободных радикалов. Столкновение радикалов может привести к обрыву процесса:
Итак, сделаем выводы.
Реакционная способность основного соединения всегда должна рассматриваться только по отношению к реагенту! Химическая реакция между двумя реагентами может рассматриваться как атака одной частицы (молекулы, атома, радикала, иона и т. д.) на другую. Различают два типа атакующих частиц — нуклеофил и электрофил. Нуклеофил (N) — это частица, которая атакует атом углерода, предоставляя ему электронную пару (т. е. является донором электронов). Как правило, такие частицы обладают основными свойствами. К нуклеофилам относятся ОН-, Сl-, S2-, NH3, Н2O, R—ОН, СН3O- и др. Электрофил (Е) — это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов), размещаемую на свободную орбиталь электрофила. Примерами частиц-электрофилов могут служить: Н3O+, Н+, HCI, HNO3, NO2+, АlСl3 и др. Итак, нуклеофилы — доноры электронов, электрофилы — их акцепторы. Если мы обратимся к ряду напряжений, то обнаружим, что ряд катионов (восстановители) проявляют нуклеофильные свойства, а анионы (окислители) — электрофильные. В зависимости от способа разрыва ковалентных связей в атакующем реагенте определяется механизм реакции. В органической химии выделяют два основных механизма реакции: радикальный (гомолитический) и ионный (гетеролитический). Вы уже знаете, что при химических реакциях происходит разрыв одних и образование других химических связей. Эти два противоположных процесса осуществляются в единстве. Разрыв ковалентной связи в исходных соединениях в органических реакциях может осуществляться двумя разными способами.
|
|
|



 Смесь хлора и метана может стоять в закрытом сосуде продолжительное время без каких-либо признаков реакции, если ее хранить в темноте и на холоде. Если же на сосуд с такой смесью падает яркий свет или эту смесь нагревают, начинается химическая реакция.
Смесь хлора и метана может стоять в закрытом сосуде продолжительное время без каких-либо признаков реакции, если ее хранить в темноте и на холоде. Если же на сосуд с такой смесью падает яркий свет или эту смесь нагревают, начинается химическая реакция.