|
|
|
|
|
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений § 8. Особенности органических реакций. Механизм реакций (окончание)1. Радикальный (гемолитический) разрыв ковалентной связи (гомолиз) (от греч. homos — «равный», «одинаковый»; lysis — «растворение», «распад»). В этом случае происходит симметричный разрыв ковалентной связи (общей электронной пары) и у каждой образующейся частицы остается по одному неспаренному электрону.
Образовавшиеся частицы называются радикалами.
Радикалы могут быть нейтральными и заряженными — ион-радикалы (катион- и анион-радикалы). Примерами свободных радикалов являются такие частицы, как СН3•, Сl•, СН3СН2• и др. Радикальному (гомолитическому) разрыву, или гомолизу, обычно подвергаются неполярные или малополярные ковалентные связи (С—С, С—Н, Cl—Cl, N—N, Вr—Вr и др.). Гомолиз осуществляется в растворах при определенных условиях (высокая температура, действие света, радиоактивное облучение), а также при проведении реакций в газовой фазе. а) взаимодействуя друг с другом, превращаются в устойчивые продукты:
СН3• + СН3• → Н3С—СН3; Н• + Н• → Н2; СН3• + Н• → СН4;
б) превращение радикалов в устойчивые продукты идет по другому пути, если в реакционную систему добавляют другие реагенты или специальные примеси (такие примеры вы встретите в ходе изучения органической химии).
2. Ионный (гетеролитический) разрыв ковалентной связи (гетеролиз) (от греч. heteros — «другой», «иной»; lysis — «распад»).
В этом случае происходит несимметричный разрыв ковалентной связи. Частица А теряет электрон, который был предоставлен ею для образования общей электронной пары, связывающей атомы или частицы А: В, приобретает положительный заряд и превращается в катион А+ (электрофил). Частица В, «захватывая» чужой электрон, превращается в отрицательно заряженный ион — анион В- (нуклеофил). Происходит гетеролиз ковалентной связи. К гетеролитическому разрыву склонны полярные и легко поляризуемые связи. Например: СН3I → СН3+ + I-. Гетеролизу способствуют полярные растворители. Основные понятия Особенности органических реакций. Механизм реакций. Простые реакции. Сложные реакции. Нуклеофил и электрофил. Радикал. Гомолиз и гетеролиз Вопросы и задания
СН3I + ОН- → СН3ОН + I-; СН2=СН2 + Вr2 → ВrСН2—СН2Вr. Среди соединений и ионов, участвующих в этих реакциях, укажите: 1) два нуклеофила;
Дайте обоснование своего выбора.
|
|
|



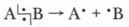
 Поскольку радикалы — неустойчивые частицы, они быстро вступают в дальнейшие реакции, стремясь превратиться в устойчивые продукты:
Поскольку радикалы — неустойчивые частицы, они быстро вступают в дальнейшие реакции, стремясь превратиться в устойчивые продукты:
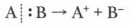
 1. Что такое механизм реакции? (Объясните на примере галоге- нирования метана.)
1. Что такое механизм реакции? (Объясните на примере галоге- нирования метана.)
 4. Запишите уравнение реакции бромирования этилена, укажите, какое из веществ является субстратом, какое — атакующим реагентом и какие — продуктами реакции.
4. Запишите уравнение реакции бромирования этилена, укажите, какое из веществ является субстратом, какое — атакующим реагентом и какие — продуктами реакции.
 5. На примере знакомых химических реакций покажите, как происходит разрыв (расщепление) ковалентных связей в молекулах исходных веществ.
5. На примере знакомых химических реакций покажите, как происходит разрыв (расщепление) ковалентных связей в молекулах исходных веществ.