|
|
|
|
|
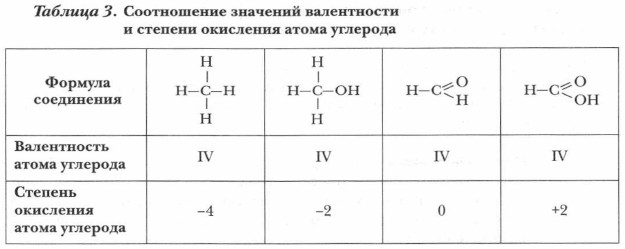
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений § 9. Классификация органических реакций (окончание)6. Реакции окисления и восстановления сопровождаются изменением степени окисления атома углерода в соединениях, где атом углерода — реакционный центр. Следует иметь в виду, что значения валентности и степени окисления углерода в органических соединениях не всегда совпадают (табл. 3).
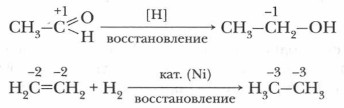
Рассмотрим примеры реакций окисления и восстановления. Пример 1. Реакция окисления характеризуется образованием новых связей углерода с более электроотрицательным элементом (галогеном, кислородом, азотом, серой и др.) и повышением положительной степени окисления атома углерода. Атом-окислитель (или восстановитель) указан в квадратных скобках.
Пример 2. Реакция восстановления характеризуется увеличением отрицательной степени окисления атома углерода и образованием новых связей С—Н.
В ходе изучения органической химии вы будете иметь дело с самыми разнообразными органическими реакциями, относящимися к различным типам. Чтобы определить их тип, раскрыть их сущность и механизм, сделать обобщение, вы будете постоянно обращаться к данной главе, дающей общие представления об органических реакциях и их типах, а также алгоритм описания реакции. Алгоритм описания химической реакции1. Схема реакции, особенности и условия ее протекания. 2. Общая характеристика природы исходных веществ (реагентов), их реакционной способности (на примере конкретной реакции). 3. Принципиальная возможность и направление химической реакции. 4. Скорость химической реакции, влияние факторов на нее. 5. Характеристика химической реакции (тепловой эффект, обратимость, катализ и т. д.). 6. Сущность и механизм химической реакции. 7. Закономерности протекания данной химической реакции. 8. Тип химической органической реакции и доказательство ее принадлежности к данному типу. Основные понятия Классификация по механизму реакций: гемолитические и гетеролитические (нуклеофильные и электрофильные). Классификация по направлению и продуктам: замещения, присоединения, элиминирования (отщепления), перегруппировки, поликонденсации, окисления и восстановления Вопросы и задания
Выводы 1. Органические реакции подчиняются общим законам (закону сохранения массы и энергии) и общим закономерностям их протекания (энергетическим, кинетическим — раскрывающим влияние различных факторов на скорость реакции). 2. Они имеют общие для всех реакций признаки, но имеют и свои характерные особенности. 3. По механизму протекания реакции делятся на гомолитические (свободнорадикальные) и гетеролитические (электрофильнонуклеофильные). 4. По направлению и конечному результату химического превращения различают реакции: замещения, присоединения, элиминирования (отщепления), перегруппировки, поликонденсации, окисления и восстановления.
|
|
|




 1. Что называется механизмом химической реакции? Как связан механизм органической реакции со строением соединения и в чем его суть?
1. Что называется механизмом химической реакции? Как связан механизм органической реакции со строением соединения и в чем его суть?
 3. Приведите примеры реакций хлора с пропаном, пропиленом и бутадиеном-1,3. Составьте уравнения соответствующих реакций и укажите их тип.
3. Приведите примеры реакций хлора с пропаном, пропиленом и бутадиеном-1,3. Составьте уравнения соответствующих реакций и укажите их тип.
 4. Приведите пример реакции полимеризации, составьте ее схему и докажите ее принадлежность к типу реакций присоединения.
4. Приведите пример реакции полимеризации, составьте ее схему и докажите ее принадлежность к типу реакций присоединения.