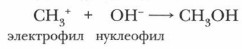|
|
|
|
|
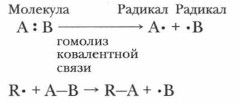
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений § 9. Классификация органических реакцийЧтобы ориентироваться в многообразии органических реакций и облегчить процесс их усвоения, необходима их классификация. Для осуществления этой логической операции надо выбрать наиболее общие классификационные признаки. Задание. Перечислите классификации химических реакций, извести ные вам из курсов химии 8-9 классов. Какие из них приемлемы для органических реакций? Приведите ваши аргументы. Безусловно, органические реакции, как и неорганические, могут быть: экзотермическими и эндотермическими; гомогенными и гетерогенными, каталитическими и некаталитическими, обратимыми и необратимыми и т. д. Их также можно классифицировать по составу исходных веществ и продуктов реакции. Все они имеют одинаковые общие признаки: образование новых веществ из исходных реагентов; общую сущность, раскрываемую с позиций электронной теории как разрыв химических связей в исходных веществах и образование новых в продуктах реакции, как правило, более стабильных и энергетически более выгодных; подчинение общим законам протекания химических реакций и закону сохранения массы и энергии. Вместе с тем органические реакции имеют свои особенности, которые обусловлены особенностями строения органических соединений (см. § 8). Большинство органических реакций включает несколько последовательных (элементарных) актов. Они характеризуются определенным направлением, а образование продуктов реакции протекает через определенные стадии. В связи с этим органические реакции принято классифицировать по механизмам их протекания, по направлению и конечным продуктам реакции. Классификация по механизму реакции1. Гомолитические (радикальные) реакции идут с образованием радикалов — частиц с неспаренным электроном. Их течение сопровождается гемолитическим разрывом ковалентной связи, т. е. разрывом электронных пар, образующих химическую связь. Эти реакции протекают в газообразной фазе или в неполярных растворителях, требуют высокой температуры или воздействия светом. Образовавшиеся радикалы в таких реакциях выступают и как реагенты, и как промежуточные продукты реакции. Новые химические связи в продуктах реакции образуются за счет электронов как реагента, так и субстрата. Запишем схему процесса:
Примером гемолитической реакции является хлорирование алканов. Эта реакция идет через определенную последовательность элементарных актов или стадий, она является цепной, так как первая стадия инициирует развитие последующих стадий,
Таким образом, механизм цепной реакции, рассмотренный выше, например хлорирования метана, принимает следующий вид:
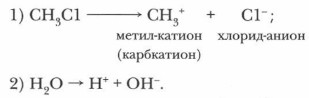
2. Гетеролитические (электрофильные-нуклеофильные, или ионные) реакции происходят без разрыва электронных пар, образующих химические связи: оба электрона переходят на орбиталь одного из атомов продукта реакции с образованием аниона. Такие реакции сопровождаются гетеролитическим расщеплением ковалентной полярной связи и образованием ионов. К гетеролитическому разрыву склонны сильно полярные и легко поляризуемые связи. В отличие от гомолитических реакций они протекают в полярных растворителях, требуют умеренной температуры и иногда катализатора. Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов):
Образовавшиеся органические ионы вступают в дальнейшие превращения, например:
В зависимости от природы атакующего реагента реакции могут быть нуклеофильными или электрофильными. Нуклеофильными называются реакции органических соединений с нуклеофильными реагентами (нуклеофилами), т. е. анионами или молекулами, которые предоставляют свою пару электронов на образование новой связи. Примером такой реакции может служить взаимодействие бромметана с гидроксидом натрия:
|
|
|



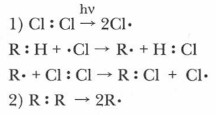
 Для свободнорадикальных реакций характерен цепной механизм, который включает три стадии: зарождение, развитие и обрыв цепи. Эти реакции прекращаются при исчезновении в системе свободных радикалов. Образование радикалов легче всего происходит при гомолизе неполярных связей между атомами простого вещества, например Сl2, Вr2, Н2, а также сложных неполярных соединений, например СН4 и др.
Для свободнорадикальных реакций характерен цепной механизм, который включает три стадии: зарождение, развитие и обрыв цепи. Эти реакции прекращаются при исчезновении в системе свободных радикалов. Образование радикалов легче всего происходит при гомолизе неполярных связей между атомами простого вещества, например Сl2, Вr2, Н2, а также сложных неполярных соединений, например СН4 и др.