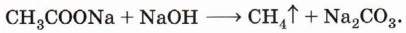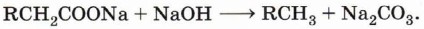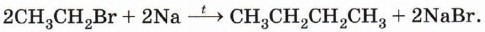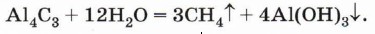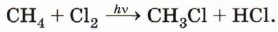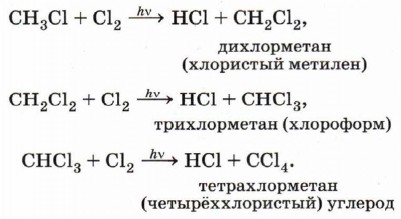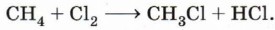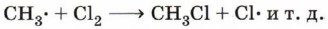|
|
|
|
|
Глава 3. Углеводороды АлканыДекарбоксилирование солей карбоновых кислот. Нагревание натриевой соли уксусной кислоты (ацетата натрия) с избытком щёлочи приводит к отщеплению карбоксильной группы и образованию метана:
Если вместо ацетата натрия взять натриевую соль пропановой кислоты, то образуется этан, из натриевой соли бутановой кислоты — пропан и т. д.:
Синтез Вюрца. При взаимодействии галогеналканов с щелочным металлом натрием образуются предельные углеводороды и галогенид щелочного металла, например:
Действие щелочного металла на смесь галогенуглеводородов (например, бромэтана и бромметана) приведёт к образованию смеси алканов (этана, пропана и бутана). Реакция, на которой основан синтез Вюрца, хорошо протекает только с галогеналканами, в молекулах которых атом галогена содержится у первичного атома углерода. Гидролиз карбидов. При обработке некоторых карбидов, содержащих углерод в степени окисления - 4 (например, карбида алюминия), водой образуется метан:
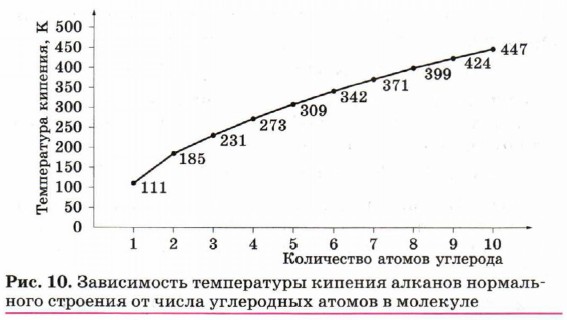
Физические свойства алкановЧетыре перых представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета и запаха (для определения утечки газа к метану, используемому в бытовых и промышленных приборах, специально добавляют меркаптаны — серосодержащие соединения с резким неприятным запахом). Углеводороды состава от С5Н12 до С15Н32 — жидкости, более тяжёлые углеводороды — твёрдые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи (рис. 10). Все углеводороды плохо растворяются в воде, жидкие углеводороды являются органическими растворителями.
Химические свойства алкановРеакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо группу. Приведём уравнения наиболее характерных реакций. Галогенирование:
В случае избытка галогена хлорирование может пойти дальше, до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные соединения в органических синтезах. В чём причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Орбитали всех атомов углерода в молекулах алканов находятся в состоянии sр3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод—углерод) связей и слабополярных С—Н (углерод—водород) связей. В них нет участков с повышенной и пониженной электронной плотностью, легко поляризуемых связей, в которых электронная плотность может смещаться под действием внешних воздействий (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, так как связи в молекулах алканов не разрываются по гетеролитическому механизму. Кинетику и механизм свободнорадикальных цепных реакций, протекающих под действием свободных радикалов (частиц, имеющих неспаренные электроны), изучал замечательный русский химик Н. Н. Семёнов. Именно за эти исследования ему была присуждена Нобелевская премия. Обычно механизм реакции свободнорадикального замещения представляют тремя основными стадиями. 1. Инициирование (зарождение цепи, образование свободных радикалов под действием источника энергии — ультрафиолетового излучения, нагревания).
2. Развитие цепи (цепь последовательных взаимодействий свободных радикалов и неактивных молекул, в результате которых образуются новые радикалы и новые молекулы). 3. Обрыв цепи (объединение свободных радикалов в неактивные молекулы (рекомбинация), «гибель» радикалов, прекращение развития цепи реакций). Рассмотрим этот механизм на примере хлорирования метана:
Инициирование цепи происходит в результате гомолитического разрыва связи Cl—Сl. Под действием ультрафиолетового облучения или при нагревании молекула хлора распадается на радикалы.
Образовавшиеся свободные радикалы атакуют молекулы метана, отрывая у них атом водорода:
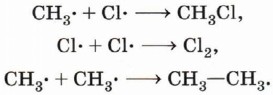
Образовавшиеся радикалы СН3•, в свою очередь, сталкиваясь с молекулами хлора, разрушают их с образованием новых радикалов:
Происходит развитие цепи. Наряду с образованием радикалов происходит их «гибель» в результате процесса рекомбинации — образования неактивной молекулы из двух радикалов:
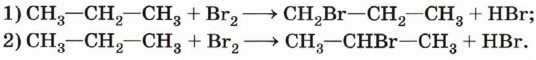
Интересно отметить, что при рекомбинации выделяется ровно столько энергии, сколько необходимо для разрушения только что образовавшейся связи. В связи с этим рекомбинация возможна только в том случае, если в соударении двух радикалов участвует третья частица (другая молекула, стенка реакционного сосуда), которая забирает на себя избыток энергии. Это даёт возможность регулировать и даже останавливать свободнорадикальные цепные реакции. Обратите внимание на реакцию образования молекулы этана (см. с. 78). Этот пример показывает, что реакция с участием органических соединений представляет собой достаточно сложный процесс. Наряду с основным продуктом в результате реакции очень часто образуются побочные продукты, что приводит к необходимости разрабатывать сложные и дорогостоящие методики очистки и выделения целевых веществ. В реакционной смеси, полученной при хлорировании метана, наряду с хлорметаном (СН3Сl) и хлороводородом, будут содержаться дихлорметан (СН2Сl2), трихлорметан (СНСl3), тетрахлорметан (ССl4), этан и продукты его хлорирования. Теперь рассмотрим галогенирование (например, бромирование) более сложного органического соединения — пропана. Если в случае хлорирования метана возможно только одно монохлорпроизводное, то в этой реакции могут образоваться уже два монобромпроизводных:
т. е. в системе может протекать одновременно несколько реакций (их называют параллельными):
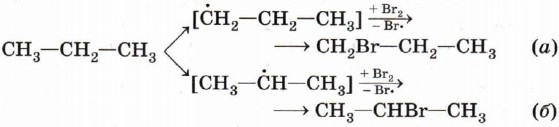
В первом случае происходит замещение атома водорода при первичном атоме углерода, а во втором — при вторичном. В конечной смеси преобладает продукт замещения атома водорода, который находится при вторичном углероде, т. е. 2-бромпропан (СН3—СНВr—СН3). Чтобы объяснить это, нам придётся воспользоваться представлением об устойчивости промежуточных частиц. Вы обратили внимание, что при описании механизма реакции хлорирования метана мы упомянули радикал метил СН3•? Этот радикал является промежуточной частицей превращения метана СН4 в хлорметан СН3Сl. Промежуточной частицей между пропаном и 1-бромпропаном является радикал с неспаренным электроном при первичном углероде, а между пропаном и 2-бромпропаном — при вторичном.
Радикал с неспаренным электроном при вторичном атоме углерода (б) является более устойчивым по сравнению со свободным радикалом с неспаренным электроном при первичном атоме углерода (а). Это объясняется стабилизацией радикала (б) двумя положительными индуктивными эффектами метильных групп при центральном углеродном атоме. Радикал (а) стабилизируется лишь одним индуктивным эффектом группы С2Н5. Кроме того, повышенную устойчивость вторичного радикала обусловливают и пространственные факторы: атом углерода с неспаренным электроном с двух сторон экранирован метальными группами, доступ к нему затруднён в большей степени, чем в случае первичного радикала (а). В полном соответствии с механизмом реакции и устойчивостью промежуточных частиц, радикал (б) образуется в большем количестве. Следовательно, основным продуктом реакции бромирования пропана является 2-бромпропан — соединение, образование которого протекает через более устойчивую промежуточную частицу.
|
|
|