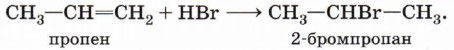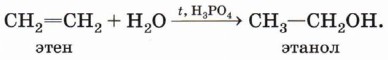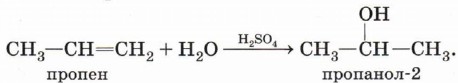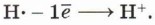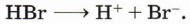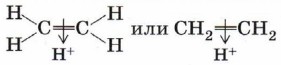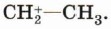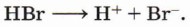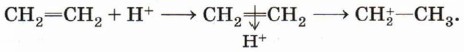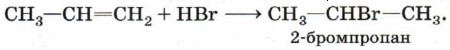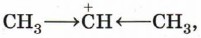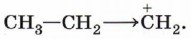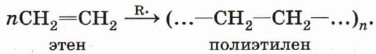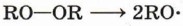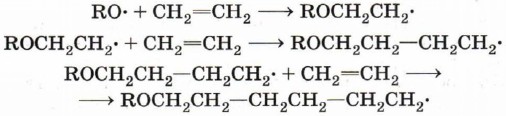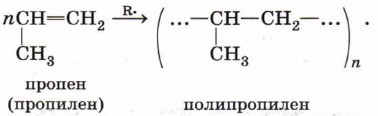|
|
|
|
|
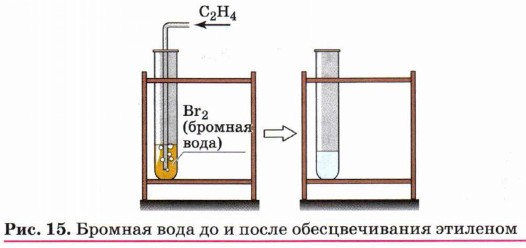
Глава 3. Углеводороды АлкеныГалогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl4) приводит к быстрому обесцвечиванию этих растворов в результате
присоединения молекулы галогена к алкену и образования дигалогеналканов (рис. 15):
Реакция присоединения галогеноводорода более подробно будет рассмотрена ниже. Эта реакция подчиняется правилу Марковникова:
Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
Обратите внимание на то, что первичный спирт (с гидроксигруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные или третичные спирты:
Эта реакция также протекает в соответствии с правилом Марковникова — атом водорода присоединяется к более гидрированному атому углерода, а гидроксильная группа — к менее гидрированному. Механизм реакций электрофильного присоединенияЭлектрофильные реакции — это реакции, протекающие под действием электрофилов — частиц, имеющих недостаток электронной плотности, например незаполненную орбиталь. Простейшей электрофильной частицей является катион водорода. Известно, что атом водорода имеет один электрон на 1s-орбитали. Катион водорода образуется, когда атом теряет этот электрон, таким образом, у катиона водорода вообще отсутствуют электроны:
При этом катион имеет высокое сродство к электрону. Сочетание этих факторов делает катион водорода достаточно сильной электрофильной частицей. Образование катиона водорода возможно при электролитической диссоциации кислот:
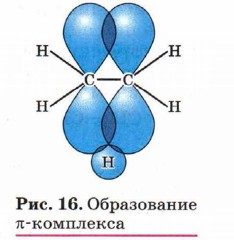
По этой причине многие электрофильные реакции идут в присутствии и с участием кислот. Электрофильные частицы действуют на системы, содержащие области повышенной электронной плотности. Примером такой системы может являться кратная (двойная или тройная) углерод-углеродная связь. Орбитали атомов углерода, между которыми образована двойная связь, находятся в состоянии sр2-гибридизации. Негибридизованные р-орбитали соседних атомов углерода, находящиеся в одной плоскости, перекрываются, образуя π-связь, которая менее прочна, чем σ -связь, и, что наиболее существенно, легко поляризуется под действием внешнего электрического поля. Это означает, что при приближении положительно заряженной частицы электроны π-связи смещаются в её сторону и образуется так называемый π-комплекс. Получается π-комплекс и при присоединении катиона водорода к π-связи. Катион водорода взаимодействует с электронным облаком π-связи двух атомов углерода и присоединяется к нему (рис. 16).
На следующей стадии происходит полное смещение электронной пары π-связи к одному из атомов углерода, что приводит к появлению на нём неподелённой пары электронов. Орбиталь атома углерода, на которой находится эта пара, и незаполненная орбиталь катиона водорода перекрываются, что приводит к образованию ковалентной связи по донорно-акцепторному механизму. У второго атома углерода при этом остаётся незаполненная орбиталь, т. е. положительный заряд:
Образовавшаяся частица называется карбокатионом, так как она содержит положительный заряд на атоме углерода. Эта частица может соединиться с каким-либо анионом, частицей, имеющей неподелённую электронную пару, т. е. нуклеофилом:
Рассмотрим механизм электрофильного присоединения на примере гидробромирования (присоединения бромоводорода) этена:
Реакция начинается с образования электрофильной частицы — катиона водорода, которое происходит в результате диссоциации молекулы бромоводорода:
Катион водорода атакует π-связь, образуя π-комплекс, который быстро преобразуется в карбокатион:
Карбокатион реагирует с нуклеофилом — бромидионом, образуя молекулу бромэтана:
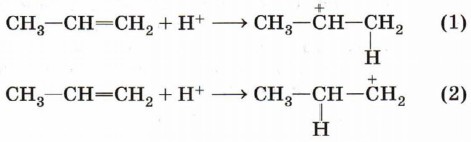
Теперь рассмотрим более сложный случай. Присоединение бромоводорода к этену протекает однозначно, а взаимодействие бромоводорода с пропеном теоретически может дать два продукта: 1-бромпропан и 2-бромпропан. Данные эксперимента показывают, что в основном получается 2-бромпропан:
Чтобы объяснить это явление, нам придётся рассмотреть промежуточную частицу — карбокатион. Присоединение катиона водорода к пропену может привести к образованию двух карбокатионов: если катион водорода присоединится к первому атому углерода (находится на конце цепи), то положительный заряд окажется у второго атома, т. е. в центре молекулы (1); если присоединится ко второму атому, то положительный заряд окажется у первого атома (2).
Преимущественное направление реакции будет зависеть от того, какого карбокатиона окажется больше в реакционной среде, что, в свою очередь, определяется устойчивостью карбокатиона. Эксперимент показывает преимущественное образование 2-бромпропана. Это означает, что в большей степени происходит образование карбокатиона (1) с положительным зарядом на центральном атоме. Большая устойчивость этого карбокатиона объясняется тем, что положительный заряд на центральном атоме углерода компенсируется положительным индуктивным (+I) эффектом двух метильных групп:
суммарный эффект которых выше, чем +I-эффект одной этильной группы:
Повышенная устойчивость карбокатиона (1) объясняется и пространственным фактором: атом углерода, несущий положительный заряд, с двух сторон защищён объёмными метильными группами. Закономерности реакций гидрогалогенирования алкенов были изучены известным русским химиком В. В. Марковниковым, учеником А. М. Бутлерова, который, как это уже было сказано выше, сформулировал правило, носящее его имя. Это правило было установлено эмпирически, т. е. опытным путём. В настоящее время мы можем привести вполне убедительное его объяснение. Интересно, что правилу Марковникова подчиняются и другие реакции электрофильного присоединения, поэтому будет правильно сформулировать его в более общем виде:
Полимеризация алкеновОсобым случаем реакции присоединения является реакция полимеризации алкенов и их производных. Эта реакция может протекать по механизму свободнорадикального присоединения, например:
Радикальную полимеризацию проводят в присутствии инициаторов — пероксидных соединений, которые являются источником свободных радикалов. Пероксидными соединениями называют вещества, молекулы которых включают группу —О—О—. Простейшим пероксидным соединением является пероксид водорода Н - О - О - Н . При температуре 100 °С и давлении 100 МПа происходит гомолиз неустойчивой кислород-кислородной связи и образование радикалов — инициаторов полимеризации.
Под действием радикалов RO- происходит инициирование полимеризации, которая развивается как реакция свободнорадикального присоединения.
В общем виде уравнение развития цепи можно записать следующим образом:
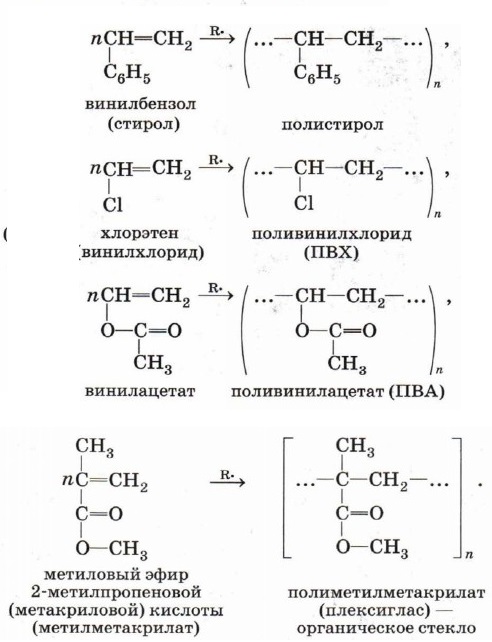
Рост цепи прекращается, когда в реакционной смеси происходит рекомбинация радикалов — полимерной цепи и радикалов RO• или ROCH2CH2•. Реакции свободнорадикальной полимеризации веществ, содержащих двойную связь, используют для получения различных высокомолекулярных соединений:
Использование в качестве исходных веществ различных органических соединений, содержащих непредельный фрагмент —СН=СН2 (эту группу называют винил), даёт возможность синтезировать богатый ассортимент полимерных материалов с заданным набором полезных свойств:
|
|
|