|
|
|
|
|
Глава 3. Углеводороды § 15. Ароматические углеводородыСтроение ароматических углеводородовВажнейший ароматический углеводород — бензол С6Н6. Предметом нашего рассмотрения будут бензол и его гомологи — продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
Бензол — первое ароматическое соединение — открыто в 1825 г. М. Фарадеем. Молекулярная формула бензола — С6Н6 (рис. 30). Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С6Н14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле углеводорода приводит появление кратных связей и циклов. В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5.
Как вы видите, молекула, соответствующая формуле Кекуле, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д. Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жёстких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к предельным углеводородам. Бензол обозначают или формулой Кекуле, или шестиугольником с окружностью внутри:
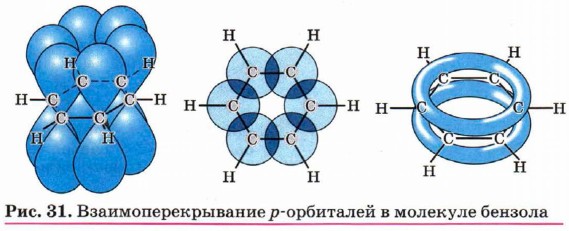
Так в чём же состоит особенность структуры бензола? На основании данных исследований и расчётов сделан вывод о том, что атомные орбитали шести атомов углерода находятся в состоянии sр2-гибридизации и лежат в одной плоскости. Негибридизованные р-орбитали атомов углерода, составляющие двойные связи (формула Кекуле), ориентированы перпендикулярно плоскости кольца и параллельны друг другу (рис. 31). Они перекрываются между собой, образуя единую π-систему. Таким образом, система чередующихся двойных связей, изображённых в формуле Кекуле, является циклической системой сопряжённых, перекрывающихся между собой π-связей. Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Из всего изложенного можно сделать вывод, что изображать бензол в виде правильного шестиугольника с окружностью в центре (π-система) более логично, чем в виде циклогексатриена-1,3,5.
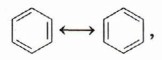
Американский учёный Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга:
т. е. считать его промежуточным соединением, «усреднением» двух структур. Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С—С-связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С-связей (0,154 нм) и длиннее двойных (0,132 нм). Существуют также ароматические соединения, молекулы которых содержат несколько циклических структур, например:
Изомерия и номенклатураДля гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метилбензол) не имеет таких изомеров, уже следующий гомолог представлен в виде четырёх изомеров.
Основой названия ароматического углеводорода с небольшими заместителями является слово «бензол». Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему.
Нумерацию проводят по самому короткому пути: например, вещество
называется 1,3-диметилбензол, а не 1,5-диметилбензол. Для дизамещённых производных бензола изомеры различаются взаимным положением заместителей в бензольном кольце. В названии изомера с расположением заместителей у соседних атомов углерода используют приставку орто- (от греч. orthos — прямой), через один атом углерода — мета- (от греч. meta — после), для находящихся напротив друг друга — пара- (от греч. рага — против). Таким образом, тривиальные названия приведённых выше диметилбензолов орто-ксилол, мета-ксилол и пара-ксилол. Физические свойства бензола и его гомологовБензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях, и при этом сами являются прекрасными растворителями органических веществ. Способы получения бензола и его гомологовОсновным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля. Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя. Для получения бензола и его гомологов можно использовать несколько реакций. Дегидрирование циклогексана:
Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Тримеризация ацетилена:
Ввести углеводородный заместитель в ароматическое кольцо (провести алкилирование) можно также несколькими способами. Синтез Вюрца—Фиттига. Это модификация уже известного нам способа получения алканов:
Алкилирование. Взаимодействие бензола и алкена в присутствии кислоты приведёт к образованию ароматического углеводорода:
Другой способ — реакция бензола с галогенпроизводным в присутствии хлорида алюминия:
Химические свойства ароматических углеводородовРеакции замещенияАроматические углеводороды вступают в реакции замещения. Галогенирование (бромирование и хлорирование). При реакции с бромом в присутствии катализатора (бромида железа (III)), один из атомов водорода в бензольном кольце может замещаться на атом брома:
Аналогично протекает хлорирование бензола:
Нитрование. Большое промышленное значение имеет реакция нитрования бензола и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (нитрующая смесь) происходит замещение атома водорода на нитрогруппу - NO2:
Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей.
|
|
|