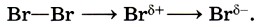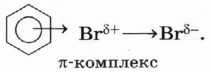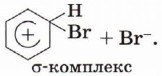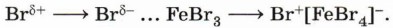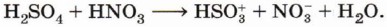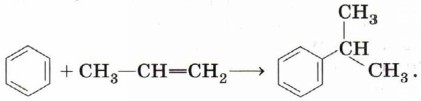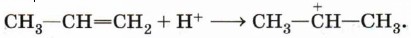|
|
|
|
|
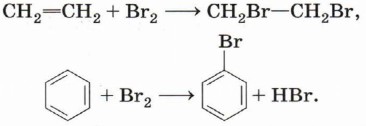
Глава 3. Углеводороды Ароматические углеводородыМеханизм реакций электрофильного замещенияРеакции замещения (бромирование, хлорирование и нитрование) протекают под воздействием электрофильных частиц, т. е. являются реакциями электрофильного замещения. Ароматическая структура бензола и подобных ему соединений обладает повышенной устойчивостью, и нарушение её энергетически невыгодно. Это оказывает влияние на химические свойства ароматических соединений. Наличие π-системы, области повышенной электронной плотности, делает структуру бензола выгодной для воздействия электрофилов, но, в отличие от непредельных соединений, эти реакции протекают не как присоединение, а как замещение. Галогенирование. Сравним механизмы реакций бромирования этена и бензола:
Присоединение брома к этену начинается с электрофильной атаки, которую можно представить как взаимодействие электронов π-связи с поляризованной молекулой Вr2. Электрофильная частица образуется при поляризации связи Вr—Вr при приближении молекулы брома к π-связи алкена:
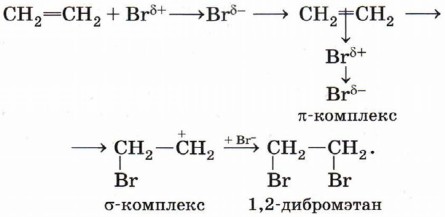
Поляризованная молекула брома взаимодействует с молекулой этена и образует тс-комплекс. На следующей стадии образуется σ-комплекс (карбокатион), стабилизирующийся за счёт присоединения брома и аниона:
При взаимодействии брома с π-системой ароматического кольца также образуется π-комплекс:
Следующей переходной частицей после π-комплекса также является σ-комплекс:
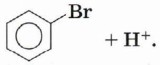
Обратите внимание, что образование этого комплекса приводит к переходу атомных орбиталей одного из атомов углерода в состояние sр3-гибридизации, нарушению ароматической π-системы (ароматичности) и снижению устойчивости соединения. По этой причине, в отличие от реакции бромирования алкена, которая заканчивается присоединением бромид-аниона к карбокатиону и образованием 1,2-дибромэтана, σ-комплекс стабилизируется в результате отщепления протона и происходит восстановление ароматичности:
Таким образом, мы показали, что нарушение ароматичности, которое происходит при разрушении циклической π-системы, энергетически невыгодно. Следовательно, реакции присоединения к аренам менее характерны, чем реакции замещения, при которых ароматическое сопряжение сохраняется. π-Система бензольного кольца является менее реакционноспособной структурой, чем π-связь в алкенах, поэтому для успешного протекания реакций необходимо применение катализаторов. Катализатором описанной выше реакции является бромид железа (III), который, образуя комплексное соединение, сильно поляризует связь Вr—Вr, увеличивая частичный положительный заряд на одном из атомов брома:
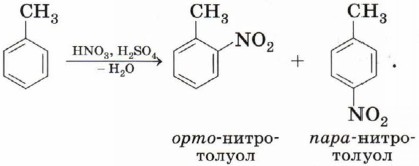
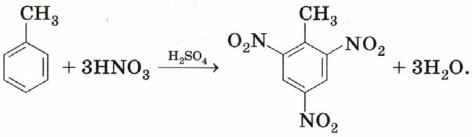
По электрофильному механизму идут многие реакции, в которых принимает участие бензол и другие ароматические соединения. Нитрование. Реакция толуола с нитрующей смесью приводит к образованию двух изомеров нитротолуола:
Образование электрофила протекает при взаимодействии азотной и серной кислот:
Алкилирование. Введение алкильного заместителя происходит с участием алкена:
Реакция протекает при наличии электрофила — карбокатиона:
Карбокатион может быть получен и другим способом:
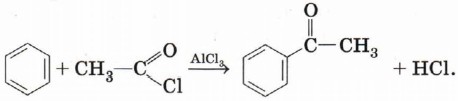
В данном случае карбокатион образуется при отщеплении хлора от хлорэтана под воздействием катализатора — АlСl3. Ацилирование. Введение ацильной группы в молекулу бензола происходит в присутствии катализатора — АlCl3:
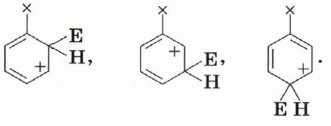
Ориентирующее действие заместителейВ молекуле бензола все атомы углерода эквивалентны. Электрофил может с равной вероятностью заместить катион водорода при любом из них. Но в случае наличия в цикле хотя бы одного заместителя реакция становится неоднозначной. Влияние заместителей в бензольном кольце на направление реакции электрофильного замещения называют ориентирующим действием заместителей. Можно сформулировать правило: Чтобы объяснить это, рассмотрим устойчивость промежуточной частицы — σ-комплекса, который образуется на одной из стадий реакции. Электрофил может присоединиться к разным атомам углерода. При этом образуются три различные частицы:
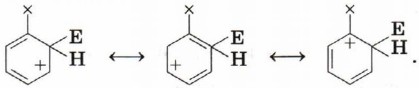
Наиболее устойчивый из образовавшихся σ-комплекс и определит направление реакции. Для оценки устойчивости переходного состояния воспользуемся теорией резонанса. По этой теории каждая переходная частица будет описываться набором граничных (канонических) структур, образующихся при «перетекании» электронной плотности по системе сопряжённых кратных связей. Атака по атомам 2 и 6 (орто-положения):
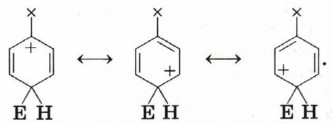
Атака по атому 4 (пара-положение):
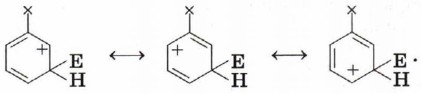
Атака по атомам 3 и 5 (мета-положения):
Видно, что при направлении атаки электрофила в положения 2, 4 и 6 образуется σ-комплекс, причём одна из граничных структур содержит положительный заряд на атоме углерода, при котором находится заместитель. Если заместитель донорный (обладает положительным индуктивным или мезомерным эффектом), то эти структуры будут стабилизированы за счёт частичной скомпенсированности положительного заряда.
Наличие акцепторного, обладающего отрицательным индуктивным или мезомерным эффектом заместителя приведёт к уменьшению стабильности таких граничных структур и σ-комплекса в целом.
В случае атаки по направлению атомов 3 и 5 не образуется ни одной структуры с положительным зарядом на атоме углерода при заместителе. В связи с этим наличие акцепторного заместителя не приведёт к снижению устойчивости переходного состояния именно в этом случае. Характер электронных эффектов групп атомов мы обсуждали в § 9. Одним из заместителей с положительным индуктивным эффектом мы назвали метильную группу —СН3 — ориентант первого рода. Поэтому метилбензол (толуол) будет нитроваться в положения 2, 4,6:
Образовавшееся соединение 2,4,6-тринитротолуол (тол, тротил) применяется как взрывчатое вещество.
|
|
|