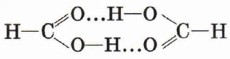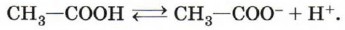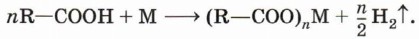|
|
|
|
|
Глава 4. Кислородсодержащие соединения § 20. Карбоновые кислотыСтроение карбоновых кислот
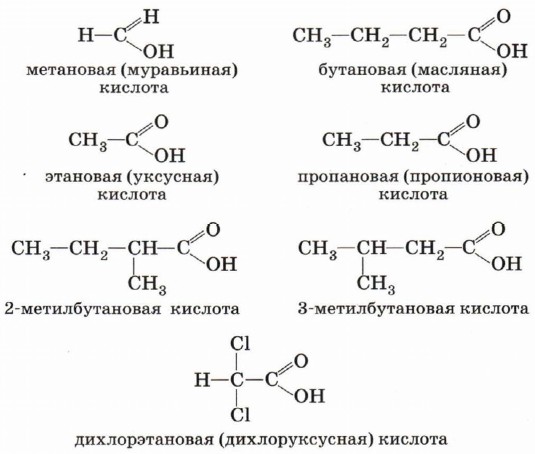
Группа атомов Органические кислоты, содержащие в молекул одну карбоксильную группу, называются одноосноеными. Общая формула этих кислот RCOOH, например
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты.
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп, например лимонная кислота трёхосновная:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные и ароматические. Предельными (насыщенными) являются, например, пропановая (пропионовая) кислота
или уже знакомая нам янтарная кислота. Очевидно, что предельные карбоновые кислоты не содержат π-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например в молекулах акриловой (пропеновой) СН2=СН—СООН, олеиновой СН3—(СН2)7—СН=СН—(СН2)7—СООН или других кислот. Как видно из формулы, бензойная кислота является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерияОбщие принципы образования названий карбоновых кислот, как и других органических соединений, мы уже рассматривали. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы.
Количество карбоксильных групп указывается в названии префиксами ди- или три-.
Многие кислоты имеют исторически сложившиеся тривиальные названия (табл. 7).
После первого знакомства с многообразным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты. Состав этих кислот отражается общей формулой СnН2nO2, или СnН2n + 1СООН, или RCOOH. Физические свойства предельных одноосновных карбоновых кислотНизшие кислоты, т. е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырёх атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от 4 до 9 атомов углерода, — вязкие маслянистые жидкости с неприятным запахом. Кислоты, состоящие из 9 атомов углерода и более, — твёрдые вещества, которые не растворяются в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна 101 °С, уксусной — 118 °С, пропионовой — 141 °С. Простейшая карбоновая кислота — муравьиная НСООН, имея небольшую относительную молекулярную массу (Мr(НСООН) = 46), при обычных условиях является жидкостью с температурой кипения 100,8 °С. В то же время бутан (Мr(С4Н10) = 58) в тех же условиях газ и имеет температуру кипения - 0,5 °С. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями.
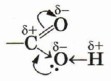
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот. Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил
(подумайте, чем вызвана полярность этой функциональной группы) и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи.
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается. Зная состав и строение молекул карбоновых кислот, нетрудно предсказать химические свойства этих веществ. Химические свойства карбоновых кислотОбщие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильно полярную связь между атомами водорода и кислорода. Эти свойства вам хорошо известны. Рассмотрим их ещё раз на примере растворимых в воде органических кислот. 1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
Более точно этот процесс описывает уравнение, учитывающее участие в нём молекул воды:
Равновесие в реакции смещено влево. Подавляющее большинство карбоновых кислот — слабые электролиты. Тем не менее кислый вкус, например, муравьиной и уксусной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков. Очевидно, что присутствием в молекулах «кислого» водорода (водорода карбоксильной группы) обусловлены и другие характерные свойства карбоновых кислот. 2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода:
Так, железо восстанавливает водород из уксусной кислоты: 2СН3—СООН + Fe → (CH3COO)2Fe + Н2↑. 3. Взаимодействие с основными оксидами с образованием соли и воды: 2R—СООН + СаО → (R—СОО)2Са + Н2O. 4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации): R—СООН + NaOH → R—COONa + Н2O,
5. Взаимодействие с солями более слабых кислот, с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия: СН3СООН + C17H35COONa →
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — уже известная вам реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода. Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении воды из реакционной смеси.
|
|
|




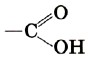 называется карбоксильной
группой или карбоксилом.
называется карбоксильной
группой или карбоксилом.