|
|
|
|
|
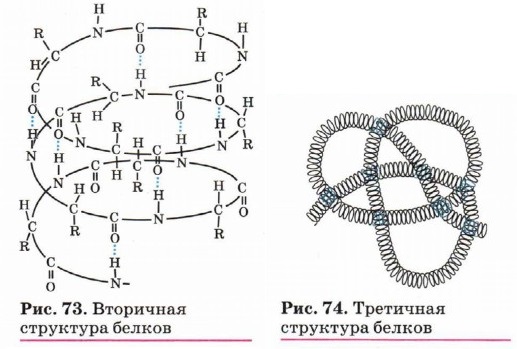
Глава 6. Азотсодержащие соединения БелкиВторичной структурой (рис. 73) обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи. Закручивание линейной полипептидной цепи в спиралевидную структуру обеспечивают внутримолекулярные водородные связи. Полипептидные цепочки с определённой вторичной структурой могут быть по- разному расположены в пространстве. Это пространственное расположение получило название третичной структуры (рис. 74).
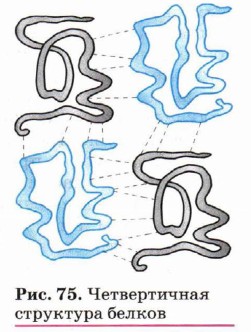
В формировании третичной структуры большую роль играют дисульфидные ионные связи, а также гидрофобное взаимодействие. По характеру «упаковки» белковой молекулы различают глобулярные (шаровидные) и фибриллярные (нитевидные) белки. Для глобулярных белков более характерна α-спиральная структура, спирали изогнуты и свёрнуты. Макромолекула имеет сферическую форму. Глобулярные белки растворяются в воде и в солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным. Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде. Фибриллярные белки обычно выполняют структурообразующие функции. Их свойства зависят от способа упаковки поли- пептидных цепочек. Примеры фибриллярных белков — миозин (мышечная ткань), кератин (роговая ткань). В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют сложные ансамбли, характеризующие четвертичную структуру белков (рис. 75). Однако следует ещё раз отметить, что в организации более высоких структур белка исключительная роль принадлежит первичной структуре.
Классификация белковСуществует несколько классификаций белков, в основе которых лежат разные признаки: Свойства белковБелки — амфотерные электролиты. При определённом значении рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка. В этой точке белки электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения их из растворов, например в технологии получения белковых продуктов. Гидратация белков. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объём увеличиваются. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (—СО—NH—, пептидная связь), аминные (—NH2) и карбоксильные (—СООН) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке, когда белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению белков в осадок. При изменении рН среды макромолекула белка приобретает заряд и его гидратационная способность меняется. При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определённой механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока), образуя растворы с невысокой концентрацией. Гидрофильные свойства белков, т. е. их способность набухать, образовывать студни, стабилизировать суспензии, эмульсии и пены, имеют большое значение в биологии и пищевой промышленности. Очень подвижным студнем, состоящим в основном из молекул белка, является цитоплазма — полужидкое содержимое клетки. Сильно гидратированный студень — сырая клейковина, выделенная из пшеничного теста (содержит до 65% воды). Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, — это набухший в воде белок, концентрированный студень, содержащий зёрна крахмала.
|
|
|