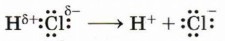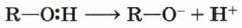|
|
|
|
|
Глава 2. Реакции органических соединений § 9. Типы реакционноспособных частиц и механизмы реакций в органической химии. Взаимное влияние атомов в молекулах органических соединенийКак вы знаете, органических соединений насчитывается более 27 млн. Несмотря на это великое множество и огромное разнообразие, их объединяют некоторые общие свойства. Органические вещества термически неустойчивы, большинство из них имеет невысокие температуры плавления и кипения, они летучи, многие обладают характерным запахом. Причина такой похожести кроется в схожем строении органических веществ, для которых характерен ковалентный тип связей между атомами и молекулярная кристаллическая решётка. Напомним, что ковалентная связь образуется при перекрывании атомных орбиталей с образованием общих электронных пар. Подавляющее большинство химических реакций начинается с разрыва химических связей в исходных веществах. При этом образуются промежуточные активные частицы, которые образуют новые химические связи, характерные для продуктов реакции. Первый этап этой цепочки — разрыв ковалентных связей — может сопровождаться образованием промежуточных частиц различного типа. Понять, каких именно, поможет повторение механизмов образования ковалентных связей. Обменный механизм образования ковалентной связи. Гемолитический разрыв связиОрбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование общей электронной пары электронов, т. е. «рождение» ковалентной связи по обменному механизму. Например, таким образом образуется связь между атомами в молекуле водорода:
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам. Процессом, противоположным образованию ковалентной связи по обменному механизму, является её разрыв, при котором каждый атом получает обратно свой электрон. В результате этого образуются две частицы, имеющие неспаренные электроны.
Такие частицы называются свободными радикалами.
Механизм разрыва ковалентной связи, при котором образуются свободные радикалы, называется гемолитическим или гомолизом (от лат. homo — одинаковый). При таком типе разрыва связи атомы в равной мере делят между собой общую электронную пару. Как вы думаете, для какого вида ковалентной связи более вероятен гомолитический разрыв — ковалентной полярной или ковалентной неполярной? Очевидно, атомы с одинаковой электроотрицательностью, связанные ковалентной неполярной связью, в равной мере стремятся вернуть себе отданный для образования электронной пары электрон, поэтому делят эту пару поровну. Следовательно, гомолитический разрыв более характерен для ковалентной неполярной (например, С—С) или ковалентной малополярной (например, С—Н) связи. Донорно-акцепторный механизм образования ковалентной связи. Гетеролитический разрыв связиКовалентная связь может образовываться по иному механизму, который носит название донорно-акцепторный. В этом случае одна из орбиталей атома, на которой находится неподелённая электронная пара (этот атом может нести отрицательный заряд), перекрывается со свободной (вакантной, «пустой») орбиталью другого атома (этот атом может обладать положительным зарядом). При этом так же, как и в случае обмена электронами, образуется общая электронная пара, т. е. ковалентная связь. Классическим примером образования связи по донорно-акцепторному механизму является взаимодействие аммиака с катионом водорода, в результате которого получается катион аммония:
Атом азота в аммиаке, обладающий неподелённой электронной парой, выполняет роль донора, катион водорода, обладающий вакантной орбиталью, — роль акцептора. Образующаяся по донорно-акцепторному механизму ковалентная связь ничем не отличается от связи, образованной по обменному механизму. Разрыв ковалентной связи, обратный её образованию по донорно-акцепторному механизму, называется гетеролитическим или гетеролизом. Такой разрыв приводит к образованию двух противоположных по характеру частиц. Одна получает неподелённую электронную пару и избыток электронной плотности, может нести отрицательный заряд, т. е. быть анионом. У другой остаётся вакантная орбиталь, и так как ей не достаётся электронов, она обладает дефицитом электронной плотности и, как правило, несёт положительный заряд, т. е. является катионом. Из курса неорганической химии вам известен гетеролиз связи Н—Сl при электролитической диссоциации хлороводорода.
В органической химии подобным образом разрывается, например, связь О—Н.
|
|
|