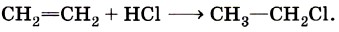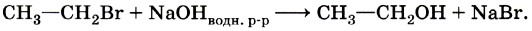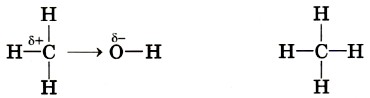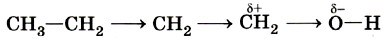|
|
|
|
|
Глава 2. Реакции органических соединений Типы реакционноспособных частиц и механизмы реакций в органической химии. Взаимное влияние атомов в молекулах органических соединенийВ общем случае гетеролитический разрыв связи можно выразить схемой:
Нетрудно догадаться, что частица, имеющая неподелённую электронную пару
Примерами нуклеофильных частиц могут служить аниомы Сl-, ОH-, СН3O-, а также нейтральные молекулы Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить её и, следовательно, притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподелённая пара электронов. Такие частицы называют электрофилами, т. е. «любящими» отрицательный заряд.
Примерами электрофильных частиц могут служить катион водорода Н+, карбокатионы типа этильного катиона Основные механизмы протекания реакцийВ предыдущем параграфе мы привели классификацию реакций в органической химии по признаку структурных изменений, происходящих в молекуле субстрата. Но ведь реагент также является полноправным участником реакции, и было бы несправедливым совсем игнорировать его в типологии реакционных процессов. Для «восстановления справедливости» химические реакции в органической химии классифицируют также по природе реагента, точнее, по типу промежуточно образующихся реакционных частиц. В соответствии с данным признаком различают радикальные, нуклеофильные и электрофильные процессы. Например, взаимодействие метана с хлором мы отнесли к реакциям замещения:
Если учесть, что активными частицами в данном процессе являются атомы хлора Сl и углеводородные радикалы типа СН3, то галогенирование алканов относится к реакциям радикального замещения. Гидрогалогенирование непредельных углеводородов относится к реакциям присоединения:
Активным реагентом в данном случае выступают катионы водорода Н+, а они, как мы только что выяснили, являются электрофильными частицами. Следовательно, реакция гидрогалогенирования алкенов — это реакция электрофильного присоединения. Щелочной гидролиз бромэтана протекает в соответствии с уравнением:
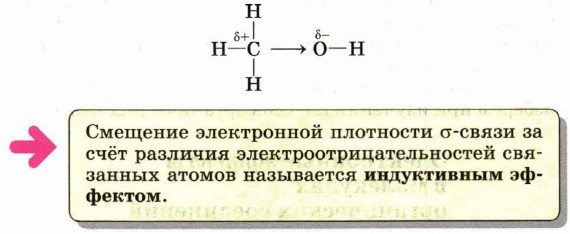
Это типичная реакция замещения. Активной частицей в данном случае являются гидроксид-ионы ОН-, имеющие нуклеофильный характер. Значит, приведённую реакцию следует отнести к реакциям нуклеофильного замещения. Любая химическая реакция протекает через образование промежуточных продуктов, проходит определённые стадии превращения исходных веществ в продукты. Последовательность этих стадий называют механизмом химической реакции. Различных механизмов реакций в органической химии достаточно много. Важнейшими из них являются механизмы реакций: Механизмы реакций обозначают буквами латинского алфавита, например SN, АЕ, SR. Первая буква говорит о характере реакции по признаку структурных изменений в молекуле субстрата: S (от англ. substitution) — замещение, А (от англ. addition) — присоединение. Подстрочный индекс указывает на природу реагента, под воздействием которого происходит реакция: N — нуклеофильные, Е — электрофильные, R — радикальные реакции. Более подробно некоторые из этих механизмов мы разберём при изучении классов органических веществ. Электронные эффекты в молекулах органических соединенийВ одной из научных статей в 1863 г. А. М. Бутлеров писал, что атомы водорода, соединённые с углеродом, ведут себя относительно реагентов иначе, чем соединённые с кислородом. Гипотеза о взаимном влиянии атомов была дополнена и расширена учениками А. М. Бутлерова, в первую очередь В. В. Марковниковым. В 1869 г. он защитил докторскую диссертацию «Материалы по вопросу о взаимном влиянии атомов в химических соединениях», в которой показал, что оказывать друг на друга влияние могут даже атомы, не связанные друг с другом непосредственно. Каким же образом атомы в молекулах влияют друг на друга? Индуктивный (индукционный) эффект. В молекуле метанола функциональная гидроксильная группа связана с метальным радикалом. Оба фрагмента оказывают друг на друга электронное влияние. Гидроксильная группа притягивает к себе электронную плотность ковалентной связи и поэтому является акцептором электронов (от англ. to accept — принимать) из-за большей электроотрицательности кислорода по сравнению с углеродом. Такое влияние называется отрицательным индуктивным эффектом и обозначается символом —IOH. Получается, что метильная группа подаёт электронную пару более электроотрицательному кислороду и является донором (от англ. to donate — отдавать), т. е. обладает положительным индуктивным эффектом (+IСH3 ). Врезультате на атоме кислорода образуется частичный отрицательный заряд, а на атоме углерода — частичный положительный, обозначаемый символом δ (дельта).
В метане по сравнению с метанолом атом углерода не имеет δ+, поскольку в молекуле отсутствует гидроксильная группа, обладающая отрицательным индуктивным эффектом. Но и сколько-нибудь заметного отрицательного заряда на атоме углерода нет, так как ковалентная связь С—Н является малополярной, а электроотрицательности углерода и водорода различаются незначительно.
Индуктивный эффект быстро затухает в цепочке атомов. Например, акцепторное влияние гидроксильной группы практически не сказывается на четвёртом в цепи углеродном атоме бутанола-1
|
|
|



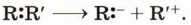
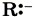 (избыток электронной плотности), будет в дальнейшем притягиваться к положительно заряженным атомам или к атомам, на которых имеется, по крайней мере, частичный (эффективный) положительный заряд. Частицы с неподелёнными электронными парами называют нуклеофильными реагентами (от лат. nucleus — ядро, положительно заряженная часть атома), т. е. «любящими» положительный заряд.
(избыток электронной плотности), будет в дальнейшем притягиваться к положительно заряженным атомам или к атомам, на которых имеется, по крайней мере, частичный (эффективный) положительный заряд. Частицы с неподелёнными электронными парами называют нуклеофильными реагентами (от лат. nucleus — ядро, положительно заряженная часть атома), т. е. «любящими» положительный заряд.

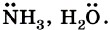

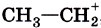 , а также нейтральные молекулы с электронодефицитным атомом углерода типа
, а также нейтральные молекулы с электронодефицитным атомом углерода типа  .
.