|
|
|
|
|
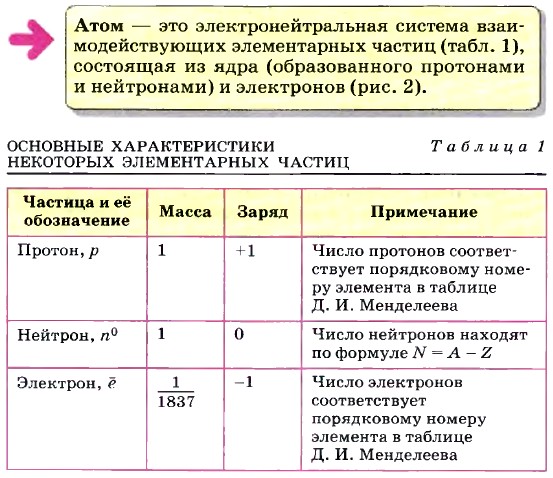
Глава первая. Углеводороды и их природные источники § 1. Основные сведения о строении атома (продолжение)В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
Атомное ядро каждого химического элемента характеризуется строго определённым числом протонов Z (т. е. определённым положительным зарядом) в нём, равным порядковому номеру химического элемента в Периодической системе Д. И. Менделеева. Число нейтронов N в атомах одного и того же химического элемента может быть различным. Следовательно, различными будут и массовые числа А (А = Z + N) у этих атомов. Такие разновидности атомов называют изотопами.
Например, в природе встречаются изотопы химического элемента кислорода с массовыми числами 16, 17 и 18 (16O, 17O и 18O), хлора — 35Сl и 37Сl, калия — 39К и 40К, аргона — 39Аr и 40Аr. Строение атомного ядра и изменения, происходящие с ним, — предмет ядерной физики. Для химии больший интерес представляет строение электронной оболочки атома. Под электронной оболочкой понимают совокупность всех электронов в атоме. Число электронов в атоме равно числу протонов и соответствует порядковому номеру элемента, так как атом электронейтрален. Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой. Наименьшей энергией обладают электроны первого электронного слоя, наиболее близкого к атомному ядру.
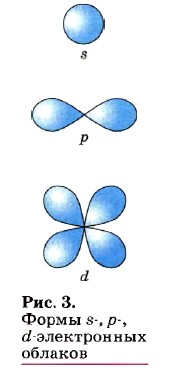
По сравнению с электронами первого слоя электроны последующих слоёв будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего слоя. Число электронных слоёв, на которых располагаются электроны в атоме конкретного элемента, соответствует номеру периода в таблице Д. И. Менделеева, в котором располагается элемент: у атомов элементов 1-го периода — один уровень, 2-го периода — два, 7-го периода — семь. Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве. Он может находиться в любой части пространства, окружающего ядро. Совокупность различных положений электрона рассматривают как электронное облако с определённой плотностью отрицательного заряда. Около ядра можно выделить пространство, где вероятность нахождения электрона наибольшая.
|
|
|