|
|
|
|
|
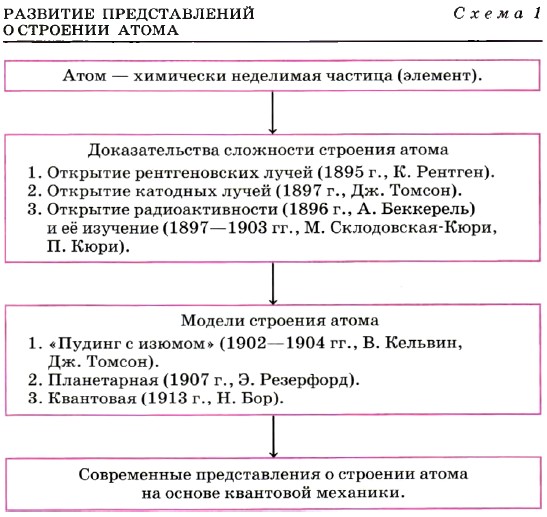
Глава первая. Углеводороды и их природные источники § 1. Основные сведения о строении атомаПонятие «атом» пришло к нам из Античности, но совершенно изменило тот первоначальный смысл, который вкладывали в него древние греки (в переводе с греческого «атом» означает «неделимый»). Этимология названия «неделимый» отражает сущность атома с точностью до наоборот. Атом делим, что доказали явления фотоэффекта, радиоактивности, электролиза (вспомните, что это такое) и др. Изучение этих явлений определило разработку различных моделей строения атома как сложной частицы. Эволюцию представлений о строении атома можно изобразить в виде схемы 1.
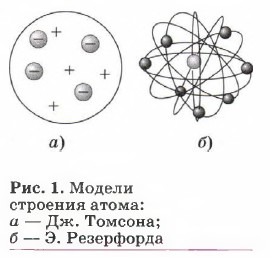
В 1904 г. в работе «О структуре атома» Дж. Томсон дал описание своей модели, получившей образное название «пудинг с изюмом». В этой модели атом уподоблен пудингу сферической формы, имеющему положительный заряд (рис. 1, а). Внутрь сферы вкраплены, как изюм в пудинге, отрицательно заряженные электроны. Электроны совершают колебательные движения, благодаря которым атом излучает электромагнитную энергию. Атом в целом элек- тронейтрален. Модель атома Дж. Томсона не была подтверждена экспериментальными фактами и осталась гипотезой. Согласно планетарной модели, предложенной Э. Резерфордом, атом состоит из положительно заряженного ядра и электронов, движущихся вокруг ядра по замкнутым орбитам, подобно движению планет вокруг Солнца (рис. 1, б). Модель Э. Резерфорда не смогла объяснить излучение и поглощение энергии атомом. В 1913 г. Н. Бор предложил квантовую модель строения атома, основанную на следующих постулатах.
Первый постулат. Электрон движется вокруг ядра по строго определённым замкнутым стационарным орбитам в соответствии с «разрешёнными» значениями энергии E1, Е2, ..., Еn, при этом энергия не поглощается и не излучается. Второй постулат. Электрон может переходить из одного «разрешённого» энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии. Н. Бор внёс квантовые представления в строение атома, но использовал при этом традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определённой скоростью по строго определённым траекториям. Его теория была построена на противоречиях.
|
|
|