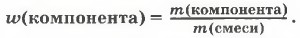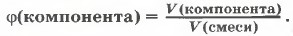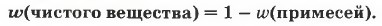|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 12. Состав вещества. СмесиВ 1799 г. французский химик Ж. Л. Пруст сформулировал один из основополагающих законов химии — закон постоянства состава веществ.
Этот закон абсолютно справедлив только для веществ молекулярного строения и не всегда соблюдается для твёрдых веществ с немолекулярной структурой (ионной, атомной, металлической кристаллическими решётками). Состав вещества записывают с помощью химической формулы. Для веществ молекулярного строения справедлив термин «молекулярная формула», поскольку она отражает состав молекулы вещества. Для веществ немолекулярного строения понятие «молекулярная формула» условно, и для них чаще используют понятие «формульная единица».
Химическая формула, или формульная единица, вещества несёт немало информации. Она обозначает конкретное химическое вещество, его название; одну молекулу (для веществ молекулярного строения), 1 моль вещества. По химической формуле также можно определить его качественный состав (т. е. из каких элементов состоит данное вещество) и количественный состав (число атомов каждого элемента в молекуле или количество вещества каждого элемента в 1 моль вещества); его относительную молекулярную (Мг) и молярную (М) массы. Например, химическая формула СН4 показывает:
Наконец, химическая формула позволяет рассчитать массовую долю каждого элемента в сложном веществе. Для нашего примера:
Аналогично можно вычислить и состав смеси. Массовую долю каждого компонента в смеси находят по формуле:
Если же смесь является газообразной, то говорят об объёмной доле компонента в газовой смеси и рассчитывают её аналогично:
Следовательно,
Доля всегда меньше единицы, поэтому её чаще выражают в процентах, т. е. умножая долю на 100% . На практике очень часто приходится иметь дело с растворами веществ, поэтому в этом случае используют понятие «массовая доля растворённого вещества», как частный случай компонента смеси — раствора:
Ещё одним частным случаем доли компонента в смеси является доля примесей, содержащихся в образце вещества. В этом случае для нахождения доли чистого вещества нужно из единицы вычесть долю примесей:
|
|
|





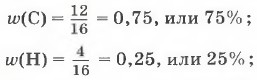
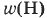 можно найти другим способом: 100% - 75% = 25%.
можно найти другим способом: 100% - 75% = 25%.