|
|
|
|
|
Глава вторая. Химические реакции § 17. Роль воды в химических реакцияхЕсли взглянуть на нашу планету из космоса (рис. 108), то мы увидим, что большая часть поверхности Земли покрыта водой.
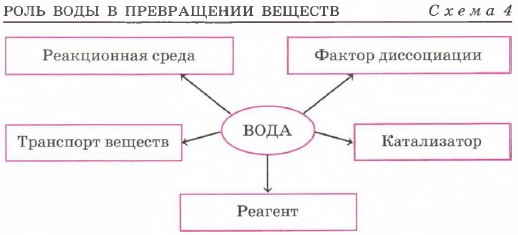
Вода — уникальное химическое вещество, роль которого в химических реакциях трудно переоценить. Схема 4 не полностью отражает многогранность роли, которую вода играет в превращениях веществ. Как и все вещества, вода подчиняется строгой логической линии «состав — строение — свойства». (Вспомните состав и строение молекул воды, роль межмолекулярных водородных связей при ассоциации их в жидкую и твёрдую воду.) Огромное число химических реакций протекает в водной среде. По растворимости в воде все вещества условно делят на три группы:
Практическим пособием для определения растворимости веществ в воде является таблица растворимости гидроксидов и солей в воде. Растворение — это не просто физический процесс — результат диффузии. При растворении веществ в воде происходит их химическое взаимодействие с ней — гидратация. Результатом такого взаимодействия является образование растворов. Именно этой точки зрения на растворение придерживался и отстаивал её великий русский химик Д. И. Менделеев.
Почему в определении растворов мы так осторожно подчеркнули: «...частиц вещества и продуктов их взаимодействия»? Как вы помните из § 11 «Дисперсные системы», истинные растворы делят на молекулярные, ионные и ионно-молекулярные. Ведь даже в молекулярных растворах веществ содержатся уже совсем не те молекулы, из которых было построено исходное вещество, например молекулы спиртов. Эти молекулы окружены оболочкой из молекул воды. Такие молекулы называют гидратированными. Они представляют собой результат взаимодействия воды с молекулами растворяемого вещества — процесса гидратации. Косвенным доказательством гидратации как химического процесса является существование твёрдых кристаллогидратов, например солей, в состав которых входит вода. Её в этом случае называют кристаллизационной. Наиболее известными кристаллогидратами являются медный купорос CuSO4 • 5Н2O, гипс CaSO4 • 2Н2O и кристаллическая сода Na2CO3 • 10Н2O. Если для молекулярных растворов всё только этим и заканчивается, то для растворов электролитов следует продолжение. Напомним:
Электролиты диссоциируют по-разному — одни хорошо, другие не очень. Эту способность электролита к диссоциации характеризует величина, называемая степенью электролитической диссоциации.
|
|
|