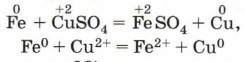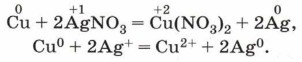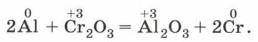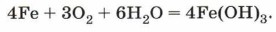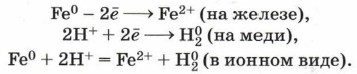|
|
|
|
|
Глава третья. Вещества и их свойства § 20. Металлы (продолжение)Взаимодействие металлов с растворами солей
Металлы взаимодействуют с растворами солей при соблюдении ряда условий: • металл должен находиться в ряду напряжений левее металла, образующего соль; • в результате реакции должна образоваться растворимая соль, так как в противном случае она покроет металл осадком и доступ соли к металлу прекратится; • для этих реакций не рекомендуется использовать щелочные металлы (почему?). Например:
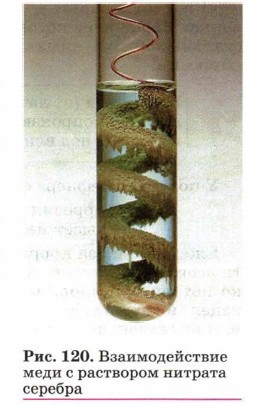
(см. рис. 98). На рисунке 120 показана красивая реакция замещения медью серебра из раствора его соли:
МеталлотермияНекоторые активные металлы — литий, магний, кальций, алюминий — способны вытеснять другие металлы из их оксидов. Это свойство используют для получения некоторых металлов, а также для изготовления термитных смесей. Так, хром получают с помощью алюминотермии:
Коррозия металлов и способы защиты от неё«Ржа ест железо» — гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, — это яркий пример коррозии.
У поэта В. Шефнера есть очень образные строчки: Коррозия — рыжая крыса,
Ежегодно из-за коррозии разрушается около четверти всего произведённого в мире железа. Однако не только потеря металлов, но и порча изготовленных из них изделий обходится очень дорого. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов и коммуникаций во много раз превышают стоимость металла, из которого они изготовлены. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей. Понятно, почему на защиту металлов и сплавов от коррозии тратят большие средства. Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металл — происходит химическая коррозия. Чаще всего коррозии подвергаются изделия из железа. Особенно сильно корродирует металл во влажном воздухе или в воде. Упрощённо этот процесс выражают с помощью следующего уравнения химической реакции:
Химически чистое железо почти не корродирует. Вместе с тем техническое железо, которое содержит различные примеси, например в чугунах и сталях, ржавеет, так как одной из причин возникновения коррозии является наличие примесей в металле, его неоднородность. Химическую сущность коррозионного процесса для этого случая покажем на следующем примере. Если два различных металла, находящихся в контакте между собой, опустить в водный раствор электролита (в реальных условиях это, например, грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, предохраняя тем самым менее активный металл от коррозии. Например, при контакте железа с медью в водной среде железо, как более активный металл, будет постепенно растворяться, переходя в воду в виде ионов железа. При этом электроны, высвободившиеся из атомов железа, перейдут к меди и на её поверхности соединятся с ионами водорода, выделившимися из компонентов водной среды (например, серной или других кислот; вам, очевидно, известно такое выражение, как «кислотные дожди»). Этот электрохимический процесс можно представить так:
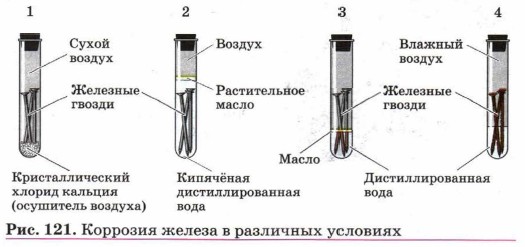
Эксперимент по влиянию условий окружающей среды на коррозию металлов представлен на рисунке 121.
|
|
|