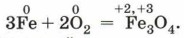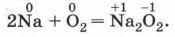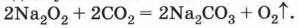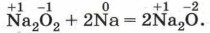|
|
|
|
|
Глава третья. Вещества и их свойства § 20. МеталлыСтроение атомов и кристаллов металлов было достаточно подробно рассмотрено в первой главе «Строение вещества», так же как их физические свойства и некоторые сплавы. Получение металлов и многие химические свойства металлов характеризовались во второй главе «Химические реакции». Поэтому дадим общий очерк химических свойств металлов. Эти свойства можно охарактеризовать выражением: все металлы проявляют только восстановительные свойства. Взаимодействие металлов с неметалламиТак как металлы являются восстановителями, то они отдают свои электроны неметаллам, которые, разумеется, проявляют при этом окислительные свойства. В результате образуются бинарные соединения, названия которых формируются по единому принципу:
Металлы взаимодействуют с галогенами с образованием солей, потому последние так и называют — галогены, т. е. «рождающие соли». Например, поваренную соль можно получить взаимодействием натрия с хлором:
В колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельчённой сурьмы (рис. 115), образуя при этом смесь хлоридов сурьмы (III) и (V):
Алюминий с иодом и с серой взаимодействует в присутствии воды. Характеризуя это свойство металлов, следует подчеркнуть, что в случае переменной степени окисления у металла продукт его взаимодействия с неметаллом зависит от окислительных свойств последнего. Например, при взаимодействии железа с серой образуется сульфид железа (II), а с хлором — хлорид железа (III) (рис. 116):
Кислород — активнейший неметалл — играет такую важную роль в химии, что великий Д. И. Менделеев предусмотрел для высших оксидов специальную графу в своей таблице. При взаимодействии с кислородом металлы образуют различные по составу продукты: оксиды, а также пероксиды. Полученные в результате таких реакций оксиды проявляют или основные, или амфотерные свойства.
Последняя реакция сопровождается выделением такого яркого света, что использовалось первыми фотографами в качестве вспышки при съёмке (современные фотографы используют электровспышку). Алюминий сгорает ярким, ослепительным пламенем, а потому в порошке применяется в качестве компонента зажигательных ракет, фейерверков, салютов, бенгальских огней и других пиротехнических средств (рис. 117):
Железо сгорает в кислороде с образованием оксида
Натрий при взаимодействии с кислородом образует не оксид, а пероксид:
Это вещество — пероксид натрия — обязательный химикат на борту подводной лодки или космического корабля, так как обладает способностью регенерировать кислород из углекислого газа:
Оксид натрия может быть получен при прокаливании пероксида натрия с натрием:
|
|
|




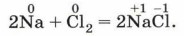
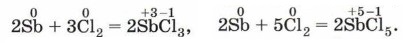
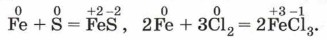


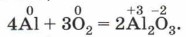
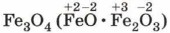 — железной окалины:
— железной окалины: