|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 4. Ковалентная химическая связь (продолжение)Нетрудно заметить, что так же, как и в случае образования ковалентной связи между атомами одного элемента, химическая связь между атомами разных элементов осуществляется за счёт образования общих электронных пар. Но всё не так просто. Паритета между атомами в этом случае не будет, так как начинает проявляться особая характеристика химических элементов, называемая электроотрицательностью (ЭО).
Важнейшие неметаллы по усилению их ЭО можно расположить в следующий ряд:
Так как разные элементы обладают разной ЭО, то общая электронная пара оказывается смещённой в сторону более электроотрицательного элемента. В результате на атоме такого элемента образуется частичный отрицательный заряд (его обозначают δ-). Соответственно на атоме менее электроотрицательного элемента возникнет такой же частичный, но уже положительный заряд (его обозначают δ+). Следовательно, по линии ковалентной связи возникнет два полюса — отрицательный и положительный. Поэтому такую ковалентную связь называют полярной. Ковалентную связь между атомами одного химического элемента называют неполярной, так как в этом случае зарядов-полюсов по линии связи не возникает. В рассмотренных примерах для молекул хлороводорода и метана связи Н—Сl и С—Н являются ковалентными полярными.
Так как ковалентная химическая связь в линейной молекуле хлороводорода полярна, полярной будет и сама молекула. В ней имеются два противоположно заряженных полюса, поэтому такие молекулы называют диполями. А вот молекула метана, несмотря на полярность каждой из связей С—Н, в целом неполярна. Это связано с тем, что молекула метана имеет тетраэдрическое строение и полярность всех связей взаимно компенсируется. Отсюда следует важный вывод: полярность молекулы зависит от полярности связей и от геометрического строения. Так, молекулы воды, имеющие угловое строение, представляют собой диполи.
Молекулы же углекислого газа, имеющие линейное строение, несмотря на высокую полярность двойной связи
В рассмотренных выше примерах образования ковалентной связи каждый из атомов предоставил в общую электронную пару по одному электрону. Такой механизм образования ковалентной связи называют обменным. Однако существует и другой механизм: один из атомов обладает свободной электронной парой (её называют неподелённой) и передаёт её в общее пользование с другим атомом, у которого имеется свободная (пустая, вакантная) орбиталь. Первый атом называют донором, а второй — акцептором. Такой механизм образования ковалентной связи называют донорно-акцепторным. Донорно-акцепторный механизм возникновения ковалентной связи рассмотрим на примере образования катиона аммония:
|
|
|







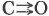 , неполярны.
, неполярны.

