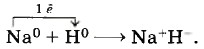|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 4. Ковалентная химическая связьВеществ с ионной химической связью немного. Гораздо больше веществ с ковалентной химической связью, что легко объяснимо. Ведь мир органических веществ, которых насчитывается более 25 млн, построен преимущественно за счёт ковалентной связи. Однако и в мире неорганических (минеральных) веществ эта химическая связь встречается довольно часто. В конце концов даже ионную связь можно считать крайним случаем ковалентной полярной химической связи. Следовательно, ковалентная связь — это преобладающая, главенствующая химическая связь в мире химических веществ. А как образуется эта химическая связь? В случае ионной химической связи атомы одного элемента отдают свои электроны, атомы других — принимают их, при этом образуются положительные и отрицательные ионы, которые за счёт электростатических сил образуют ионное химическое соединение. А как нейтральные атомы удерживаются в одном веществе? Каков механизм образования ковалентной химической связи? Рассмотрим его на примере молекулы водорода Н2. Атомы водорода стремятся быть похожими на атомы благородного газа гелия, внешний электронный слой которого содержит два электрона. Если атом водорода встретится с атомом металла (например, щелочного или щёлочноземельного), то атом металла передаст атому водорода электроны с внешнего электронного слоя, и... возникнет ионная химическая связь, образуются гидриды, например:
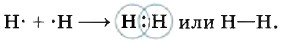
(Каков характер кристаллической решётки у этих соединений? Какими физическими свойствами они обладают?) Другое дело, если встречаются два одинаковых атома водорода. В этом случае проблему завершения внешнего электронного слоя эти атомы будут решать на паритетных началах — просто-напросто объединят свои электроны, сделают их общими, т. е. создадут общую электронную пару. При этом электронные облака или орбитали (очевидно, вы не забыли, что у водорода это 1s-орбитали) перекроются, и в пространстве между ядрами двух атомов водорода возникнет некоторая дополнительная электронная плотность — отрицательный заряд, стягивающий положительные ядра взаимодействующих атомов:
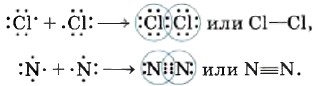
Сближение ядер будет происходить до тех пор, пока силы межъядерного отталкивания не будут уравновешены силами притяжения к общей электронной плотности. Так образуется ковалентная связь во всех двухатомных молекулах простых веществ (одинарная в молекулах галогенов F2, Сl2; тройная в молекулах азота N2 и др.):
Дадим определение понятия «ковалентная химическая связь».
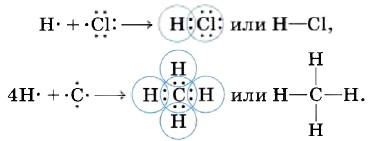
Аналогичный механизм образования ковалентной химической связи наблюдается и между атомами разных элементов, например:
|
|
|