|
|
|
|
|
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения Классификации химических элементов и открытие периодического закона (дополнительный материал к § 12)Для систематизации химических элементов необходимо было вначале классифицировать их. Вы уже знакомы с классификациями растений, животных, физических явлений, веществ, химических реакций.
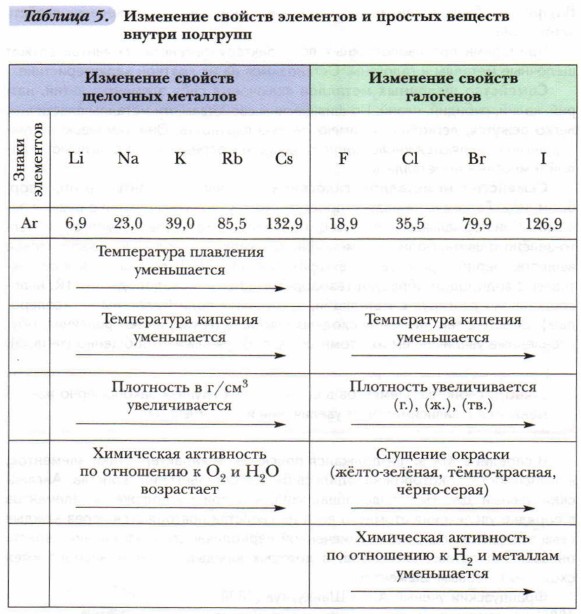
Классификация — это распределение объектов и явлений по классам, группам, семействам на основе их общих признаков. Одной из первых классификаций элементов было их распределение на металлы и неметаллы по общим физическим свойствам. Делались попытки объединить элементы по сходству их свойств в отдельные группы, семейства и даже найти общие закономерности, характерные для выявленных групп этих элементов. Каждый химический элемент весьма индивидуален по своей природе, но в то же время у отдельных элементов имеются сходные признаки. Основываясь на них, немецкий учёный И. Дёберей- нер объединил сходные между собой элементы в триады, например: галогены (Cl, Br, I); щёлочноземельные металлы (Са, Sr, Ва). Он сравнил их атомные веса и обнаружил, что значение атомного веса промежуточного в триаде элемента равно среднему арифметическому атомных весов крайних элементов триады. Сходные по свойствам элементы были также объединены в естественные семейства (группы). Внутри них были установлены даже закономерности в изменении свойств элементов. Примерами противоположных по характеру семейств элементов служат щелочные металлы и галогены. Остановимся на их краткой характеристике. Семейство щелочных металлов включает в себя элементы: литий, натрий, калий, рубидий, цезий. По физическим свойствам эти металлы пластичны, легко режутся, легкоплавки, имеют малую плотность. Они химически активны: легко окисляются кислородом воздуха, непосредственно реагируют с водой и многими неметаллами. Семейство неметаллов галогенов включает элементы: фтор, хлор, бром, иод. Галогены образуют простые молекулярные вещества с резким запахом. При нормальных условиях фтор и хлор — газы бледно-жёлтого и жёлто-зелёного цвета, бром — тёмно-красная жидкость, иод — кристаллическое вещество чёрно-серого цвета, в парах фиолетовое. Галогены химически активны: с водородом образуют газообразные галогеноводороды — HR; непосредственно реагируя с металлами, «рождают» соли (галогены — «солероды»). Вместе с тем элементы сходных семейств (групп) имеют различия, обусловленные увеличением их атомных масс. Выразим их обобщённо (табл. 5).
В середине XIX в. продолжался поиск такой характеристики элементов, в зависимости от которой находились бы все остальные их свойства. Английский учёный Дж. Ньюлендс обнаружил, что при расположении элементов в порядке увеличения атомного веса их свойства повторяются через каждые семь элементов. На основе замеченной периодичности в изменении свойств он выделил октавы элементов, в которых каждый восьмой элемент имел сходство с первым элементом.
Французский учёный А. де Шанкуртуа (1820—1886) расположил известные в то время химические элементы по спирали с увеличением их атомного веса. В полученной спирали одни элементы располагались под другими таким образом, что удалось установить сходство некоторых из них по вертикали. Немецкий исследователь В. Мейер расположил сходные элементы в вертикальные столбцы и получил таблицу элементов. Он ближе всех подошёл к открытию закона периодичности, но не сумел сделать нужные теоретические обобщения. Безуспешность поиска общего закона, который позволил бы свести все элементы в единую систему, объяснялась тем, что учёные устанавливали и анализировали закономерности изменения свойств элементов лишь в сходных их группах. Они не пытались соединять все известные элементы между собой, сравнивать друг с другом противоположные по свойствам группы. Вместе с тем в этих научных поисках прослеживалась определённая логика развития науки: от накопления и анализа фактов к их систематизации, а затем к выявлению закономерностей.
|
|
|