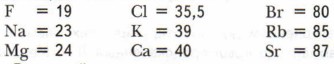|
|
|
|
|
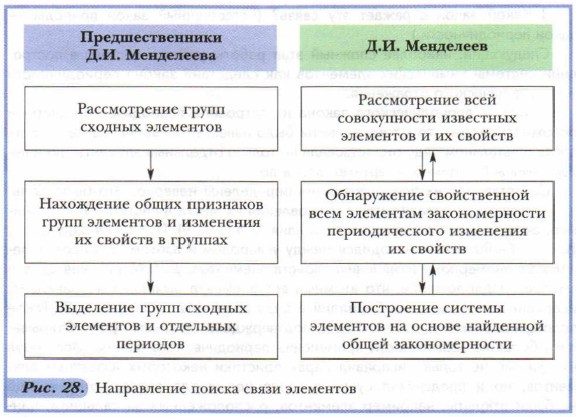
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения Классификации химических элементов и открытие периодического закона: Дополнительный материал к § 12В отличие от своих предшественников (рис. 28), Д.И. Менделеев сравнивал не только сходные, но главным образом несходные между собой элементы и их группы (например, щелочные металлы и галогены), располагая их на основе главной (известной к тому времени) характеристики элемента — атомного веса.
Д.И. Менделеев сопоставил элементы разных групп, располагая их в порядке возрастания атомных весов:
«В этих трёх группах видна суть дела», — писал Д.И. Менделеев. Галогены обладают меньшим атомным весом, чем щелочные металлы, а они — меньшим, чем щёлочноземельные металлы. При этом в непрерывном ряду элементов: F, Na, Mg, ..., Cl, К, Са, ..., Br, Rb, Sr, ..., несмотря на пропуски многих из них, видно, что свойства элементов меняются периодически, т. е. резкий переход от металла к неметаллу сменяется плавным переходом от щелочного металла к щёлочноземельному и уменьшению основных свойств их соединений. На основе всестороннего и глубокого анализа, сравнения, синтеза и обобщения всех накопленных знаний об элементах, а также благодаря гениальной научной интуиции Д.И. Менделеев открыл в 1869 г. периодический закон. Открытие периодического закона позволило ответить на следующие вопросы. 1. Что общего у всех химических элементов? (Атомный вес.) 2. Есть ли связь между атомным весом и свойствами элементов? (Связь существует в виде зависимости свойств от атомного веса.) 3. Какой закон отражает эту связь? (Естественный закон природы — закон периодичности.) Следующий, наиболее сложный этап работы учёного состоял в построении системы химических элементов как следствия закона периодичности и его графического отражения. Открытие периодического закона и построение периодической системы осложнялись тем, что к тому времени было известно лишь 64 элемента. В их последовательном ряду отсутствовали не только отдельные элементы, но и целые группы (например, инертные газы и др.). Свойства многих элементов были определены неверно. Это было большой помехой для правильного установления их места в системе. Так, например, считалось, что атомный вес бериллия 13,5 (а не 9). Поэтому в ряду Li, ..., В, С, ... бериллий Be находился между углеродом и азотом. Это противоречило закономерному изменению свойств элементов. Д.И. Менделеев сделал смелое предположение, что атомный вес элемента вычислен неправильно, исправил его и поставил бериллий в ряду элементов между Li и В. Такое положение элемента затем и было подтверждено опытным путём. Открывались большие возможности применения периодического закона. Используя их, учёный не только исправил характеристики некоторых известных элементов, но и предсказал существование новых элементов, которые ещё не были открыты, например элементов, расположенных за кальцием, цинком и др. Д.И. Менделеев не только предсказал, но и с большой точностью описал элементы, которые назвал экаалюминием, экабором, экасилицием (стоящие ниже Аl, В, Si). Учёные всего мира с нетерпением ждали открытия этих элементов. В 1875 г. француз Л. де Буабодран открыл предсказанный Д.И. Менделеевым элемент «экаалюминий» и назвал в честь своей родины галлием (старинное название Франции — Галлия). В 1879 г. Л. Нильсон обнаружил и назвал скандием описанный Д.И. Менделеевым элемент «экабор». В 1886 г. К. Винклер открыл третий предсказанный элемент «экасилиций» и также назвал его в честь родины германием. Учёных поразила необыкновенная точность, с которой эти неизвестные ещё элементы были описаны Д.И. Менделеевым, например галлий (табл. 6).
После этих открытий на основе периодического закона стали прогнозировать открытие новых элементов и уточнять свойства имеющихся. Открытие группы инертных элементов, или, как их ещё называют, «благородных газов», расширило периодическую систему. Позже Д.И. Менделеев использовал введённую им более фундаментальную, чем атомный вес, характеристику элементов, а именно их порядковый номер (физический смысл порядкового номера объяснили позднее). Были установлены закономерности изменения свойств элементов в периодах и группах. Шли поиски удобного табличного выражения периодической системы как естественной классификации элементов.
|
|
|