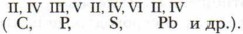|
|
|
|
|
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения Валентность химических элементов. Определение валентности в бинарных соединениях
Как вы уже знаете, состав веществ устанавливается на основании данных эксперимента. До сих пор мы пользовались готовыми формулами. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы. Задание. Определите количественный состав веществ, формулы которых приведены ниже:
Формулы веществ показывают, что атомы соединяются между собой в различных соотношениях. В хлороводороде на один атом водорода приходится один атом хлора, в сероводороде на один атом серы приходится два атома водорода, в аммиаке на один атом азота — три атома водорода, в метане — четыре атома водорода на один атом углерода. Для определения состава бинарных (или двухэлементных, т. е. состоящих из атомов двух химических элементов) соединений и составления их формул достаточно знать валентность (от лат. valentia — «сила») химических элементов. С середины XIX в. известно следующее определение валентности.
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) связей, которые данный атом образует с другими атомами. С современным определением валентности вы познакомитесь позднее, в § 44. Изучение состава веществ, образованных атомами водорода и других элементов, показало, что атом водорода не может присоединять более одного атома других элементов. Это позволило принять валентность водорода за единицу. Дальнейшие рассуждения могут быть построены следующим образом: если в состав молекулы хлороводорода входит по одному атому водорода и хлора, значит, валентность хлора в данном случае также равна единице. Поскольку в молекуле сероводорода содержится один атом серы и два атома водорода, значит, валентность серы в два раза превышает валентность водорода и равна двум:
Атомы химических элементов проявляют валентность только в соединениях. Наряду с элементами, всегда проявляющими постоянную валентность Единицу валентности условно можно изобразить в виде валентной черты, соединяющей символы атомов элементов. Такой вид представления молекул называется графической формулой. Например, по такой формуле видно, что в молекуле сероводорода каждый атом водорода проявляет валентность I, а валентность атома серы — II; в молекуле оксида углерода (IV) каждый атом кислорода проявляет валентность II, а валентность углерода — IV.
|
|
|



 Какую информацию содержит формула химического соединения? Что нужно знать, чтобы составить формулы веществ?
Какую информацию содержит формула химического соединения? Что нужно знать, чтобы составить формулы веществ?

 Свойство атомов присоединять определённое число других атомов называется валентностью.
Свойство атомов присоединять определённое число других атомов называется валентностью.
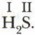 (Значение валентности принято указывать римской цифрой над символом химического элемента:
(Значение валентности принято указывать римской цифрой над символом химического элемента: 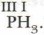 ) По аналогии можно определить валентности атомов азота, углерода и кислорода в следующих соединениях:
) По аналогии можно определить валентности атомов азота, углерода и кислорода в следующих соединениях: 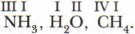 Итак, запомним:
Итак, запомним:
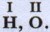
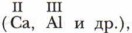 существует множество элементов, проявляющих переменную валентность
существует множество элементов, проявляющих переменную валентность