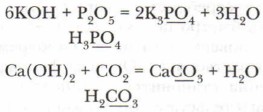|
|
|
|
|
Глава 6. Основные классы неорганических соединений § 36. Щёлочи, их свойства и способы получения
Физические свойства щелочей. В лабораторной практике часто приходится использовать растворы щелочей. А как они выглядят в твёрдом состоянии? Познакомимся поближе с наиболее распространёнными и имеющими самое широкое применение щелочами. Это гидроксиды натрия, калия и кальция. Все перечисленные гидроксиды очень похожи. Это едкие кристаллические вещества белого цвета, очень гигроскопичные. На ощупь они мылкие, своё название — «едкие» — оправдывают тем, что при попадании на кожу вызывают ожоги, разрушают многие органические вещества, в том числе шерсть и шёлк. При работе с щелочами следует соблюдать правила техники безопасности. Кристаллические щёлочи следует брать только шпателем (или пинцетом). При попадании раствора щёлочи на кожу необходимо смыть раствор большим количеством воды до исчезновения ощущения пылкости, а затем нейтрализовать раствором борной кислоты.
При растворении щёлочи в воде выделяется большое количество теплоты (см. рис. 14, с. 21). Едкие щёлочи широко используют в различных химических производствах, в частности при изготовлении мыла, красок (например, гуаши); в щелочных аккумуляторах.
Гидроксиды лития, натрия и калия устойчивы к нагреванию. Например, едкий натр способен кипеть при t = 1400 °С, не разлагаясь. Химические свойства щелочей. Изучая свойства оксидов и кислот, мы уже рассмотрели часть химических свойств, которые характерны для щелочей. Обобщим и расширим имеющиеся знания. 1. Щёлочь + кислотный оксид В реакциях между щёлочью и кислотными оксидами образуются соль и вода (реакции обмена). Поскольку в формуле оксида, являющегося ангидридом фосфорной кислоты, не представлен в явном виде кислотный остаток соответствующей оксиду кислоты, предлагается под формулой оксида записывать формулу соответствующей ему кислоты (см. алгоритм на с. 148. § 34.):
2. Щёлочь + кислота Это уже известная нам реакция нейтрализации (реакция обмена): 2NaOH + H2SO4 = Na2SO4 + 2Н2O + Q При выполнении реакций этого вида, как мы уже говорили, следует пользоваться индикатором.
|
|
|



 Почему щёлочи относят к гидроксидам?
Почему щёлочи относят к гидроксидам?