|
|
|
|
|
Глава 6. Основные классы неорганических соединений § 37. Нерастворимые основания, их получение и свойства. Амфотерность
Каждый раз перед проведением реакций с нерастворимыми основаниями приходится получать их в свежеосаждённом виде. Запомните: для получения нерастворимого основания к раствору соли необходимо по каплям приливать раствор щёлочи — до образования осадка. Раствор соли, образовавшийся одновременно с осадком нерастворимого основания, следует слить, а полученный гидроксид использовать для химических реакций. Например, для получения гидроксида меди (II) надо взять раствор любой соли меди и раствор любой щёлочи: CuCl2 + 2КОН = Си(ОН)2↓ + 2КСl
Для нерастворимых оснований характерны два общих свойства: они растворяются в растворах сильных кислот и разлагаются при нагревании (в отличие от щелочей) на соответствующий оксид и воду. Подтвердим существование этих свойств с помощью лабораторных опытов. Последовательность опытов представлена на рисунке 68.
Составьте уравнения проведённых реакций: 1) Cu(OH)2 ↓ + H2SO4 = CuSO4 + 2Н2O Признак реакции: растворение студенисто-голубого осадка, образование раствора голубого цвета.
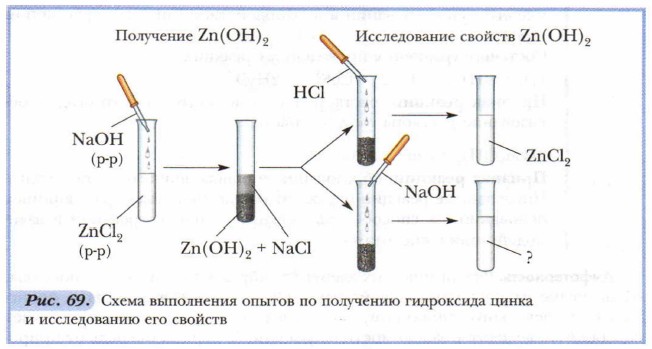
Признак реакции: образование порошка чёрного цвета и воды. Проделанные реакции отражают общие свойства нерастворимых оснований: их способность разлагаться при нагревании и взаимодействии с кислотами. Амфотерность. Ряд химических элементов образуют оксиды и гидроксиды, обладающие амфотерными свойствами. Слово « амфотерность» происходит от греческого amphoteros, что значит «и тог и другой», и отражает способность веществ в зависимости от условий (в первую очередь от природы вещества, с которым вступает в реакцию) проявлять либо основные, либо кислотные свойства.
Цинкат натрия Na2ZnO2 образуется при сплавлении гидроксида цинка со щёлочью. В растворе образуется комплексная соль — тетрагидроксоцинкат натрия Na2[Zn(OH)4]. Амфотерные основания способны к взаимодействию как с кислотами, так и со щелочами. Такая двойственность свойств обусловлена особенностями строения амфотерных гидроксидов. Амфотерные гидроксиды соответствуют амфотерным оксидам, которые также могут взаимодействовать как с кислотами, так и со щелочами.
Основные понятия Нерастворимые основания • Свойства нерастворимых оснований • Амфотерность • Амфотерные соединения Вопросы и задания
|
|
|



 Приведите примеры растворимых и нерастворимых в воде веществ.
Приведите примеры растворимых и нерастворимых в воде веществ.
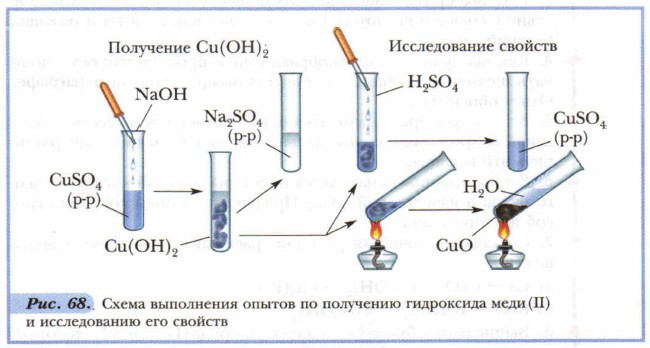
 Рассмотрите рисунок 68 и постарайтесь устно описать порядок действий при выполнении лабораторного эксперимента. Выполните опыты: получение гидроксида меди (II) Си(ОН)2, разложение его при нагревании и взаимодействие Си(ОН)2 с раствором h2so4.
Рассмотрите рисунок 68 и постарайтесь устно описать порядок действий при выполнении лабораторного эксперимента. Выполните опыты: получение гидроксида меди (II) Си(ОН)2, разложение его при нагревании и взаимодействие Си(ОН)2 с раствором h2so4.
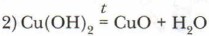
 1. Из перечня формул малого химического тренажёра (см. табл. 20, с. 144) выберите формулы тех веществ, которые вступают в реакцию: а) с КОН; б) с Fe(OH)3; в) с Са(ОН)2. Составьте соответствующие уравнения реакций.
1. Из перечня формул малого химического тренажёра (см. табл. 20, с. 144) выберите формулы тех веществ, которые вступают в реакцию: а) с КОН; б) с Fe(OH)3; в) с Са(ОН)2. Составьте соответствующие уравнения реакций.
 2. Пользуясь таблицей растворимости, составьте уравнения реакций получения в лаборатории следующих нерастворимых оснований: Pb(OH)2, Аl(ОН)3, Mg(OH)2, Fe(OH)2.
2. Пользуясь таблицей растворимости, составьте уравнения реакций получения в лаборатории следующих нерастворимых оснований: Pb(OH)2, Аl(ОН)3, Mg(OH)2, Fe(OH)2.
 5. Начертите в тетради схему генетической связи классов неорганических соединений и разместите в ней амфотерные соединения Аl2О3 и Аl(ОН)3. Пунктирными линиями обозначьте их химические свойства. Обсудите схему с товарищем.
5. Начертите в тетради схему генетической связи классов неорганических соединений и разместите в ней амфотерные соединения Аl2О3 и Аl(ОН)3. Пунктирными линиями обозначьте их химические свойства. Обсудите схему с товарищем.