|
|
|
|
|
Глава 6. Основные классы неорганических соединений § 38. Химические свойства солей. Генетическая связь неорганических соединений
Изучая химические свойства классов неорганических соединений, мы познакомились с одним из общих свойств солей — взаимодействием их растворов с растворами щелочей. Например: FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl Если в состав соли входит металл, образующий нерастворимое основание, то эти реакции можно рассматривать и как способ получения нерастворимых оснований. Уже из данного свойства ясно, что способность конкретной соли (например, хлорида серебра, нитрата свинца или любой другой) вступать в те или иные химические реакции зависит от её растворимости в воде. Взаимодействие солей со щелочами не единственное их свойство. Они также вступают в реакции замещения с металлами, более активными, чем тот, который образует соль (стоящими в ряду активности металлов левее): CuSO4 + Zn = ZnSO4 + Сu Многие соли способны вступать в обменные реакции с кислотами и другими солями. Эти виды химических взаимодействий будут изучены нами позже. Классификация и генетическая связь неорганических соединений
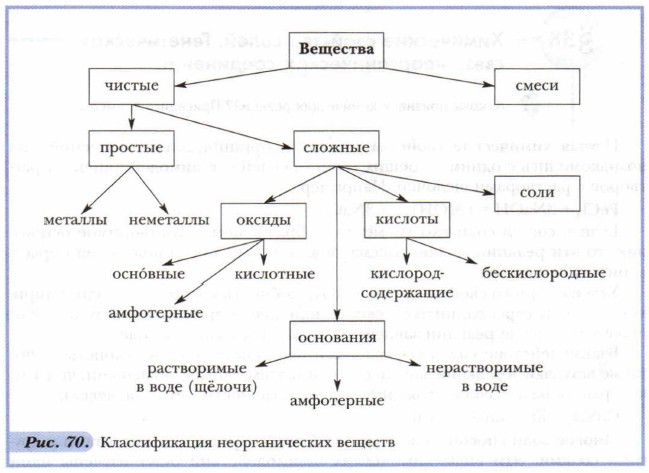
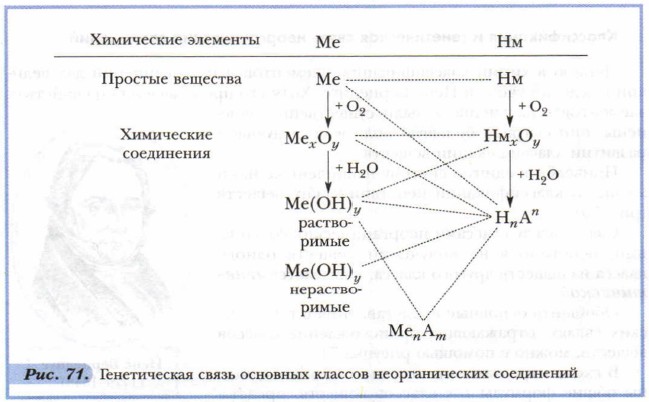
Первую в химии классификацию элементов и их соединений дал великий шведский учёный Йенс Берцелиус. Хотя его представления о свойствах элементов в дальнейшем были существенно изменены, они сыграли большую роль в последующем развитии классификации веществ. Приведём в единую систему накопленные нами знания о классификации неорганических веществ (рис. 70). Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого класса, называется генетической. Обобщить основные представления о генетических связях, отражающих происхождение классов веществ, можно с помощью рисунка 71.
В схеме отрезками пунктирных линий соединены общие формулы тех классов веществ, представители которых при определённых условиях способны вступать друг с другом в химические взаимодействия.
Сu → СuО → Cu(NO3)2 → Сu(ОН)2 → СuО → CuSO4
5. Пользуясь малым химическим тренажёром (табл. 20, с. 144) (учитель укажет вам номер варианта), выполните следующие задания:
|
|
|



 Каковы признаки химических реакций? Приведите примеры.
Каковы признаки химических реакций? Приведите примеры.

 1. Составьте уравнения реакций, раскрывающие следующие превращения:
1. Составьте уравнения реакций, раскрывающие следующие превращения:
 2. С какими из перечисленных веществ вступит в реакции раствор гидроксида кальция (известковая вода): хлорид цинка, железо, оксид серы (IV), сульфат меди (II), нитрат свинца (II), оксид железа (II), бромоводородная кислота?
2. С какими из перечисленных веществ вступит в реакции раствор гидроксида кальция (известковая вода): хлорид цинка, железо, оксид серы (IV), сульфат меди (II), нитрат свинца (II), оксид железа (II), бромоводородная кислота?
 6. Составьте схемы генетической связи соединений, образованных атомами элементов № 5, 13, 14, 17, 33, 34 в периодической таблице.
6. Составьте схемы генетической связи соединений, образованных атомами элементов № 5, 13, 14, 17, 33, 34 в периодической таблице.