|
|
|
|
|
Глава 7. Строение атома § 40. Строение электронных оболочек атомов
Свойства электронов описываются законами микромира. Экспериментально и теоретически установлено, что электроны как микрочастицы обладают двойственной природой, т. е. для них характерны свойства как частицы (имеют определённую массу, размеры ит.д.), так и волны (не имеют траектории движения, определённого положения в пространстве и обладают другими волновыми свойствами). Последнее вы узнаете из курсов физики и химии старших классов.
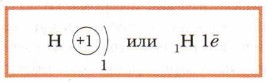
Быстро движущийся электрон может находиться в любой точке пространства, окружающего ядро атома, и на разном удалении от него, образуя электронную оболочку. Поэтому принято говорить о вероятности пребывания электрона в той или иной части внутриатомного пространства (рис. 72). Электрон движется вокруг ядра с огромной скоростью, при которой его отрицательный заряд как бы размазывается в пространстве. Максимальная плотность отвечает наибольшей вероятности пребывания электрона в данной области атомного пространства. Электроны в атоме различаются своей энергией. Чем ближе электроны находятся к ядру, тем они прочнее связаны с ним и их труднее «вырвать» из электронной оболочки. Чем дальше располагаются электроны от ядер атомов, тем легче их «оторвать». В электронной оболочке атома электроны располагаются в определённом порядке. Условно можно считать, что они размещаются слоями. Как уже говорилось, эти слои не имеют чётких границ и постепенно переходят друг в друга. Каждый электронный слой состоит из электронов с близкими значениями энергии, поэтому их ещё называют энергетическими уровнями. Число энергетических уровней, или электронных слоёв, в атоме совпадает с номером периода периодической системы, в котором находится соответствующий химический элемент. Число энергетических уровней в атоме: n = 1, 2, 3, 4, 5, б, 7.... Установлено, что в первом слое (ближайшем к ядру атома) находится максимальное число электронов — 2. Во втором слое может располагаться максимально 8 электронов, в третьем слое — 18 электронов, а в четвёртом — 32 электрона. Таким образом, максимальное число электронов, находящихся на энергетическом уровне, можно определить по формуле: 2n2, где n — номер энергетического уровня. Слой в атоме, содержащий максимально возможное для него число электронов, называют завершённым электронным слоем. Например, атом водорода имеет в периодической системе Д.И. Менделеева порядковый номер 1, следовательно, заряд ядра атома равен +1, и в его электронной оболочке находится 1 электрон.
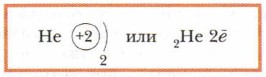
Следующий элемент в 1-м периоде — гелий. Заряд ядра атома гелия +2, количество электронов -2.
У гелия электронный слой завершён. У лития появляется второй электронный слой, поэтому он находится во 2-м периоде периодической системы Д.И. Менделеева.
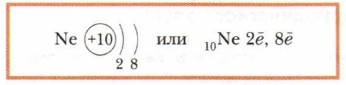
Далее в атомах элементов 2-го периода происходит заполнение второго электронного слоя до 8 электронов (у неона).
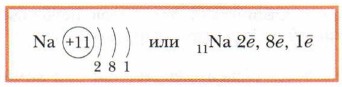
У следующего по порядку атома (у натрия) появляется третий электронный слой.
Слой, для которого характерна наименьшая энергия взаимодействия электрона с ядром, называется внешним. Внешний электронный слой всегда содержит не больше 8 электронов (кроме элементов 1-го периода). Основные понятия Электронный слой • Энергетический уровень • Завершённый электронный слой • Внешний электронный слой Вопросы и задания
|
|
|



 Как определить число электронов в атоме?
Как определить число электронов в атоме?


 1. Почему правильно говорить о вероятности пребывания электрона в той или иной части атомного пространства?
1. Почему правильно говорить о вероятности пребывания электрона в той или иной части атомного пространства?
 4. Соедините стрелками распределение электронов по электронным слоям и названия соответствующих элементов.
4. Соедините стрелками распределение электронов по электронным слоям и названия соответствующих элементов.