|
|
|
|
|
Глава 8. Периодический закон и периодическая система Д.И. Менделеева § 41. Периодические изменения свойств химических элементов. Современная трактовка периодического закона
Для описания и систематизации химических элементов необходимо знать их характеристики: порядковый номер (заряд ядра его атомов) и относительную атомную массу. Из них заряд ядра атомов является общей, неизменной при химических реакциях главной характеристикой для определения элемента. Для описания элементов, кроме перечисленных выше количественных характеристик, нужны и другие, в том числе качественные, характеристики элемента. Таковыми являются электронное строение и свойства его атомов. Особое значение имеют электроны, расположенные на внешнем электронном слое, — валентные электроны. У элементов-металлов их обычно 1-2, реже 3, у неметаллов — 4 и больше. У элементов больших периодов побочных подгрупп валентными являются электроны не только внешнего, но и предвнешнего слоя. От валентных электронов зависит реакционная способность атомов к образованию химических связей с другими атомами, к образованию химических соединений.
Простые и сложные вещества — это формы реального существования элементов в природе. Характер элементов влияет на свойства образованных ими веществ, и наоборот, зная свойства веществ, можно судить о характере элемента.
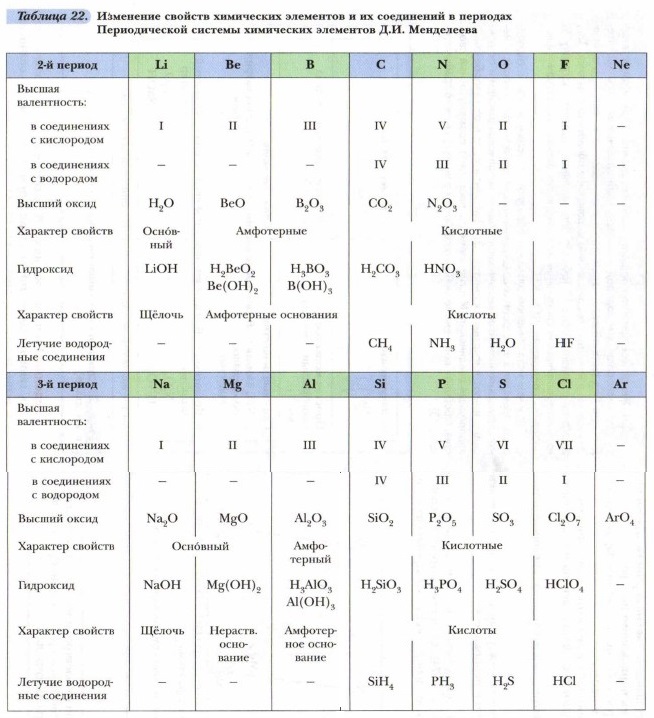
Задание. Пользуясь таблицей 22, выявите периодические изменения свойств элементов, а также форм и свойств их соединений с возрастанием порядкового номера с № 1 по № 20.
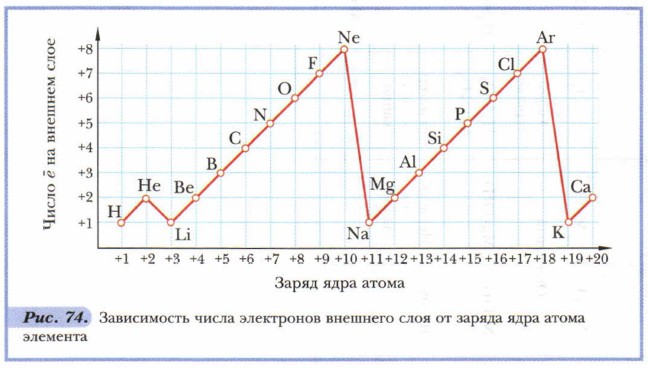
На основе проделанного анализа выведем закономерности изменения свойств элементов с увеличением их порядкового номера: Проблема. Какова зависимость между характеристиками элемента, меняющимися монотонно и периодически? Рассмотрим эту связь на примере заряда ядра атомов и их внешних электронов. Для этого построим график (рис. 74). Отметим на горизонтальной линии заряд ядра атома (Z), а на вертикальной — число электронов на внешнем слое атомов элементов.
|
|
|



 С какими свойствами-характеристиками элементов вы знакомы? Влияют ли свойства элементов на свойства образованных ими веществ? Дайте менделеевскую формулировку периодического закона. Объясните ход мысли Д.И. Менделеева при классификации элементов.
С какими свойствами-характеристиками элементов вы знакомы? Влияют ли свойства элементов на свойства образованных ими веществ? Дайте менделеевскую формулировку периодического закона. Объясните ход мысли Д.И. Менделеева при классификации элементов.
 Химическое соединение — это химически индивидуальное вещество, состоящее из химически связанных атомов одного (простое вещество) или нескольких (сложное вещество) элементов, имеющее определённый состав.
Химическое соединение — это химически индивидуальное вещество, состоящее из химически связанных атомов одного (простое вещество) или нескольких (сложное вещество) элементов, имеющее определённый состав.