|
|
|
|
|
Глава 9. Строение вещества Ковалентная связь атомов при образовании молекул простых веществС учётом сказанного выше составим схему образования молекулы водорода:
Подобным образом осуществляется связь между атомами фтора, но у них формируется завершённый внешний восьмиэлектронный уровень. Схема образования молекулы фтора — F2:
В молекулах водорода и фтора атомы связаны одной общей электронной парой. Такую связь называют одинарной. Химическая связь между атомами в молекулах может быть образована с помощью большего числа электронных пар. Это зависит от строения взаимодействующих атомов. Рассмотрим, как образуется молекула азота. Химический элемент азот расположен в V группе главной подгруппы (VA-группе) периодической системы элементов, следовательно, на внешнем электронном слое у атома азота 5 электронов, из которых 3 — неспаренных (8 - V = 3):
С помощью обобществления электронных пар объединяются атомы в двухатомной молекуле азота N2. Связь между атомами здесь тройная:
Увеличение числа электронных пар, связывающих атомы в молекулу, увеличивает прочность молекул:
Приставка ко- означает «совместное участие». В данном случае — участие двух атомов в реализации своей валентности. С помощью ковалентной связи между атомами неметаллов образуются молекулы простых веществ, а также многих сложных веществ.
Основные понятия Химическая связь • Валентность • Валентные электроны • Ковалентная связь • Общая электронная пара Вопросы и задания
|
|
|



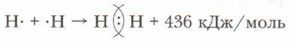
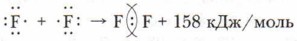
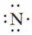
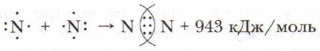

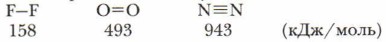
 Химическая связь между атомами, осуществляемая общими электронными парами, называется ковалентной.
Химическая связь между атомами, осуществляемая общими электронными парами, называется ковалентной.
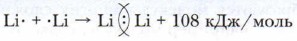
 1. Какая химическая связь называется ковалентной? Почему она так названа?
1. Какая химическая связь называется ковалентной? Почему она так названа?
 2. Изобразите схему образования молекулы водорода и кислорода, объясните механизм образования химической связи.
2. Изобразите схему образования молекулы водорода и кислорода, объясните механизм образования химической связи.
 3. При каких условиях атомы одного элемента могут соединяться друг с другом, образуя молекулы простых веществ, и в чём особенность этой ковалентной связи?
3. При каких условиях атомы одного элемента могут соединяться друг с другом, образуя молекулы простых веществ, и в чём особенность этой ковалентной связи?
 4. Сравните химические связи между атомами в молекулах фтора, кислорода и азота. В чём сходство и различия в образовании молекул этих веществ?
4. Сравните химические связи между атомами в молекулах фтора, кислорода и азота. В чём сходство и различия в образовании молекул этих веществ?